北海道大学大学院薬学研究院教授 松田 正

免疫系、造血系、神経系等の高次生体システムの恒常性を維持するためには液性の調節因子であるサイトカインの存在が不可欠であり、サイトカインが細胞膜上に存在するサイトカイン受容体に結合すると、受容体に恒常的に会合するチロシンキナーゼファミリー分子JAKが活性化され、その主要基質であるSTAT蛋白をリン酸化する。リン酸化STAT蛋白は2量体を形成し、核内に移行し、個々のサイトカイン特異的遺伝子群のプロモーター領域に結合し、転写因子として作用する。
このサイトカインのシグナル伝達系はJAK-STAT系と呼ばれ、種々の高次生体システムの維持、制御に重要な役割を果たすことが報告されており、その破綻はがんや自己免疫疾患などの疾患発症の引き金となる。中でも免疫系細胞の増殖分化に関与するサイトカインであるインターロイキン6(IL-6)は、細胞膜上のIL-6受容体であるgp130分子に会合するJAKやSTAT3を介して細胞内にシグナルを伝え、その多彩な生物活性を発現する。
私は、1986年のIL-6の遺伝子クローニングに始まり、IL-6依存性細胞や測定系の樹立から多彩なIL-6生物活性の同定や種々の免疫疾患との関連を明らかにし、さらにIL-6遺伝子改変マウス作成により、生体におけるIL-6の生物活性や免疫疾患との関連を証明した。
これら一連の研究は現在100カ国以上で治療に使われ、国内でも約1万人以上の患者に投与されている慢性関節リウマチ治療薬「トシリズマブ」開発の礎となっている。
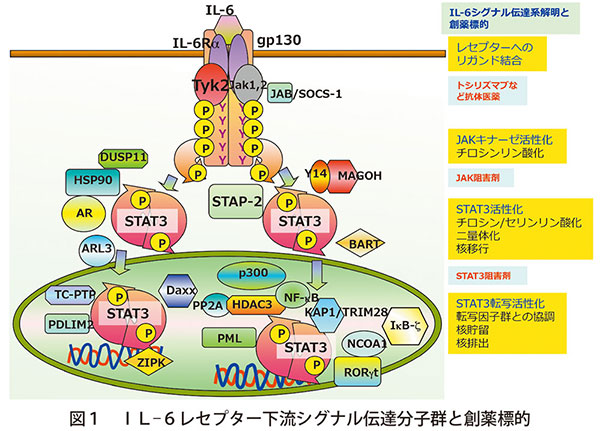
疾患治療における重要性の観点からもIL-6受容体下流シグナルの本体と考えられるSTAT3の制御機構は創薬標的となり得る。その制御を担う分子群の同定を進め、STAT3ホスファターゼTC-PTPやSTAT3ユビキンリガーゼPDLIM2などを明らかにしている(図1)
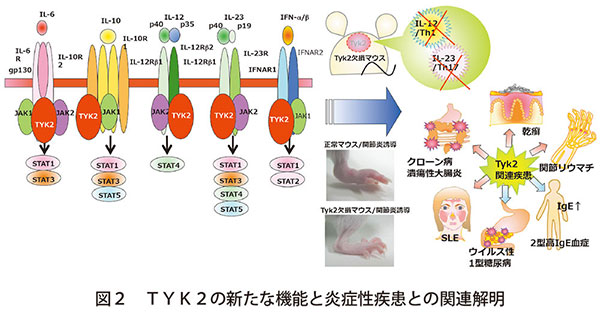
また、STAT3を活性化するJAKの一つ、TYK2を欠損するマウスは、自己免疫疾患発症に関与するヘルパーT細胞群Th17の分化に重要であり、遅延型アレルギーモデル、乾癬モデル、炎症性腸炎モデル、関節炎モデルなど種々の炎症性疾患の発症が軽減されることを明らかにした(図2)
これらの知見は現在始まっている乾癬、SLEや潰瘍性大腸炎に対するTYK2阻害剤「デュクラバシチニブ」の治験への展開からも非常に先駆的な研究であり、TYK2阻害剤は第3の新型コロナ治療薬として承認されたJAK阻害薬「バリシチニブ」に続く大きな可能性も秘めている。
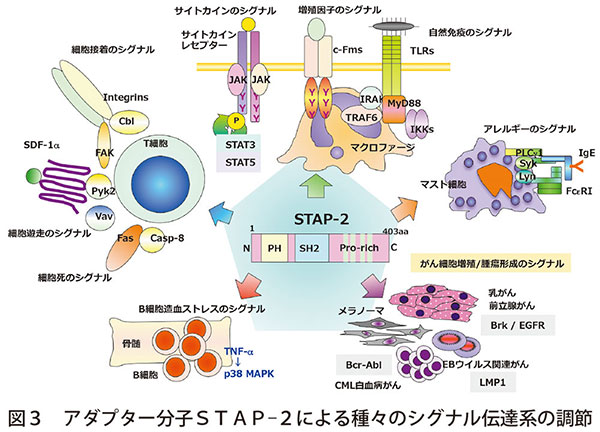
さらに、STAT3活性を調節するアダプター蛋白STAP-2は様々な細胞内シグナル伝達を制御する重要な分子であることも示した(図3)
特にSTAP-2欠損マウスでは敗血症モデルでの肝急性期蛋白誘導の低下は、STAP-2がIL-6刺激による転写因子STAT3のリン酸化・活性化を増強することに起因することを明らかにした。
また、STAP-2発現はアレルギー応答を担うマスト細胞のIgE/FcεRIシグナル伝達経路や炎症性サイトカインIL-33シグナル活性化を抑制し、アレルギー反応を抑制する機能を有すること、マクロファージにおけるLPS/TLR4シグナル伝達を亢進させること、EBウイルス感染B細胞でのLMP1によるNF-κBの活性を抑制することなどを明らかにした。
STAP-2は免疫応答の中枢を担うT細胞の接着やケモカインによる細胞遊走、活性化細胞死を制御することやB細胞造血ストレスを制御する分子でもある。STAP-2は乳がん細胞や前立腺がん、メラノーマ、慢性骨髄性白血病(CML)細胞の増殖調節に関与する。
以上、サイトカインシグナル伝達を制御するSTAT3やTYK2、STAP-2の発現量や機能を制御することにより、炎症・免疫反応を人為的に操作することは可能であり、新規創薬につながることを期待している。