河井 真、宍戸 貴雄、上原 健城、土屋 賢二(塩野義製薬)
インフルエンザウイルス感染症は一般的に冬季に流行し、日本、米国、欧州諸国各々の地域で毎年1000~2000万人が罹患する呼吸器感染症である。WHOの試算によれば、全世界のインフルエンザ関連重症例数は年間300~500万人、死者例数は25~50万人と見積もられている。また、人類はこれまでパンデミックと呼ばれる新型ウイルスの大流行を経験しており、全世界で100万人規模の死亡例が認められている。治療にはノイラミニダーゼ(NA)阻害薬が使用されているが、これらのNA阻害薬は、ハイリスク患者や重症患者で明確な治療効果を示した例が限られていることなど、治療機会が限定されているのが現状であり、幅広い患者に対して利便性が高くより有効性の高い治療薬が望まれている。
バロキサビルマルボキシルは、インフルエンザウイルスが有する増殖に必須のメタロ酵素であるキャップ依存性エンドヌクレアーゼ(CEN)の阻害剤であり、同じメタロ酵素であるHIV(ヒト免疫不全ウイルス)インテグラーゼ阻害剤ドルテグラビルで培った社内メタロ酵素に対する創薬ノウハウに基づき創製された化合物である。
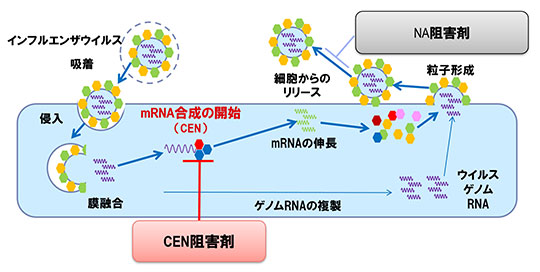
本化合物は非臨床試験において、既存薬と比較して強いウイルス増殖抑制効果を示し、その後の臨床試験においても強い抗ウイルス効果を示したことから、臨床予測性の高い非臨床モデルが構築できたと考えている。
臨床試験を開始後、先駆け審査指定制度の指定を受け、異例の速さ(約3年)で承認を取得した。短い期間ではあったが、単回投与によるインフルエンザ罹病期間の短縮についてのプラセボ優越性、さらにウイルス排出期間などの抗ウイルス効果におけるプラセボおよびオセルタミビル優越性、安全性など必要なデータを収集した。
その結果、CENを標的としたファースト・イン・クラスとして、バロキサビルマルボキシルは2018年に日本と米国で「A型またはB型インフルエンザウイルス感染症」の効能・効果で承認された。その後も香港やタイなど順次製造承認を取得し、21年11月現在、世界約69カ国で承認されている。なお、現時点で、バロキサビルマルボキシルは、世界で唯一のCENを阻害するインフルエンザウイルス感染症治療薬である。



















