筆者:Vishal Chakravarty
欧州における医薬品の市場アクセスの状況は二分化しました。かつては欧州医薬品庁(EMA)が統括する統一的な規制エコシステムでしたが、現在はEUのEMA主導の枠組みと、英国の独立したMHRA運営の制度という、2つの並行した制度になっています。この分離は2021年1月1日に確定し、2025年1月1日にウィンザー・フレームワークを通じて調整が加えられたことで、製薬企業がこれらの市場にアクセスする方法を根本的に変えました。
これは単なる官僚的な摩擦にとどまらず、基盤となる市場構造そのものを組み替え、両制度を理解する事業者にとって明確に異なる機会を生み出しています。
ブレグジット後の現実:2つの独立した制度
MHRAによる英国市場アクセス
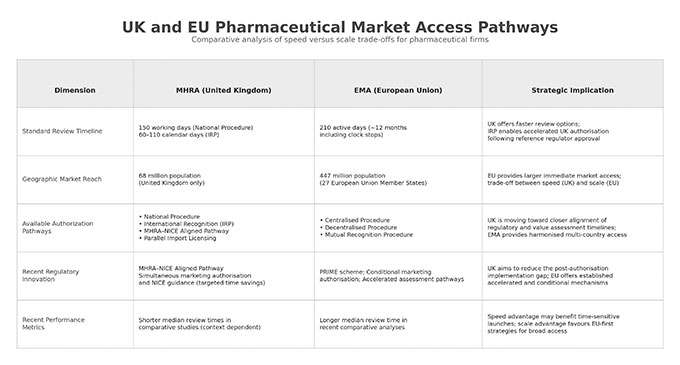
英国のMedicines and Healthcare products Regulatory Agency(MHRA)は現在、主に4つのルートを運用しています:
1. ナショナル・プロシージャ
- 標準的な期間:バリデーション(受理確認)から150営業日
- 英国の販売承認取得に向けて、MHRAのみに申請します
- 独自審査であり、EMAの判断には依拠しません
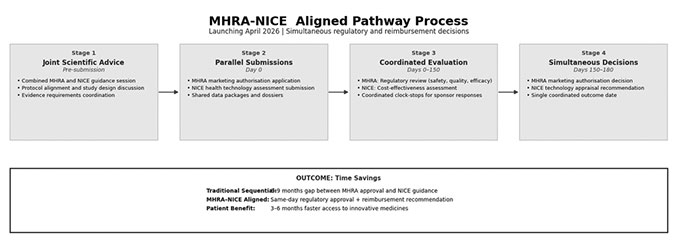
2. MHRA–NICE アラインド・パスウェイ(2026年4月開始予定)
MHRA(Medicines and Healthcare products Regulatory Agency)とNICE(National Institute for Health and Care Excellence)は最近、販売承認と医療技術評価の判断を同時に行える統合ルートを発表しました。
この新たな仕組みにより、従来の『MHRAの承認→NICEの費用対効果ガイダンス』という順番に伴う時間差が解消されます。見込まれる短縮効果は、患者アクセスまで3~6か月です。このルートでは、規制当局の承認とNHS償還推奨を同日に受けられるため、英国での商業化までのタイムラインを大幅に圧縮できる可能性があります。
両機関の窓口を一本化する共同の科学的助言サービスが、2026年4月に開始されます。
3. 国際承認認定手続(International Recognition Procedure)
ウィンザー・フレームワーク以降、従来のリライアンス手続が進化したものです。MHRAは、EMA、FDA、TGA(オーストラリア)、Health Canada、Swissmedic(スイス)、PMDA(日本)による承認を認定できるようになります。時間面での利点として、参照当局が製品を承認した後、適格性に応じて、MHRAは国際承認認定手続(IRP)により、バリデーションから起算してRecognition A(暦日60日)またはRecognition B(暦日110日)で英国の販売承認を付与する場合があります。
4. 並行輸入ライセンス
ウィンザー・フレームワークの実施により、2025年1月1日から、並行輸入ライセンスは北アイルランドを含む英国全域を対象とするようになりました。すべての並行輸入には、MHRAが発行するPLPIライセンスが必要です。
申請区分には、シンプルPLPI(英国とEUの供給元製品の権利者が同一、またはライセンス契約がある場合)と、ノンシンプルPLPI(権利者が異なり、生物学的同等性を示す詳細な比較分析が必要な場合)があります。
2025年1月1日からの新たな表示要件として、すべての並行輸入品には『UK Only』の表示が求められます。
EMAによるEU市場アクセス
EUは、英国を除外した形で、従来の3つのルートを維持しています:
1. 集中審査手続(Centralized Procedure)
- アムステルダムのEMAに直接申請します
- 標準的な期間:アクティブ日数210日(通常、クロックストップを含めて約12か月)
- 決定はEU加盟27か国すべてに適用されます
- バイオテク由来製品、希少疾病用医薬品、先進医療医薬品(ATMP)、および特定の治療領域における新有効成分を含む製品では必須です
2. 分散審査手続(Decentralized Procedure)
- EU加盟国のいずれにおいても未承認の製品が対象です
- 参照加盟国(RMS)と関係加盟国(CMS)へ同時に提出します
- 期間:約210日
- 結果:複数の加盟国で整合した国内販売承認が付与されます
3. 相互承認手続(Mutual Recognition Procedure)
- 少なくとも1つのEU加盟国ですでに承認されている製品が対象です
- 期間:基本90日。ただし懸念が生じた場合は150日まで延長される可能性があります
- 『公衆衛生に対する潜在的な重大リスク』が特定されない限り、他の加盟国は承認を認めなければなりません
比較分析:MHRAとEMA
MHRAは近年、主要規制当局の中でも中央値でより短い審査期間を達成してきました。ただしこれは、移行期の手続を通じてEMAの判断に依拠していたことが一部要因でした。ウィンザー・フレームワークによりそうした取り決めが終了したことで、MHRAが大規模に独自審査を行った場合のスピードは、今後明らかになっていく段階です。
ウィンザー・フレームワークが並行輸入に与える影響
ウィンザー・フレームワーク合意(2025年1月1日実施)により、北アイルランドにおける医薬品供給の規制分断が解消されました。
ウィンザー・フレームワーク以前:
- 並行輸入には、GB(グレートブリテン)専用と北アイルランド(NI)専用の別々の承認が必要でした
- 北アイルランドの中央審査品は、引き続きEUルールに従っていました
- 規制の複雑さ:同一製品でも、英国の仕向け地によって必要なライセンスが異なりました
ウィンザー・フレームワーク以後:
- 単一の英国全域PLPIライセンスで4つの構成国すべてをカバーします
- MHRAが、英国のすべての並行輸入における唯一のライセンス当局になります
- 既存のGB専用PLPIは、2025年1月1日に自動的に英国全域の承認へ切り替えられました
このルートにより、並行輸入事業者はEU加盟国から医薬品を調達し、MHRAの1つのライセンスで英国全域に供給できるようになります。従来必要だった二重ライセンスに伴うコストと物流の複雑さが解消されます。
ブレグジット後の規制分岐:制度の相違点
ブレグジットにより規制は分離しましたが、英国とEUはいずれもWHOガイドラインに整合したGMPおよびGDP基準を維持しています。一方で、重要な相違点も生じました:
ファーマコビジランス報告:EUはEudraVigilanceに報告し、英国はMHRAのYellow Cardシステムに報告します。製薬企業は、副作用報告の二重システムを維持する必要があります。
Qualified Person(QP)による認証:EUでは、EEA加盟国に所在するQPがバッチリリリースを担うことが求められます。英国では、別途、英国に拠点を置くQPが必要です。両市場に供給する企業は、両法域でQP体制を確保する必要があります。
臨床試験の承認:英国の臨床試験規則は2026年4月28日に大幅な更新が予定されており、EUの臨床試験規則との距離がさらに広がります。このため、英国とEUで実施する試験では、臨床試験申請、倫理審査承認、試験登録をそれぞれ別に行う必要があります。
製造要件:2025年7月23日以降、英国の規則では特定製品について分散型製造が認められます。この規制上の革新は、EUの枠組みには見られません。
市場参入における戦略的含意
制度の二分化により、企業のリソースとターゲット市場に応じて、3つの異なるアプローチが生まれます:
EU先行、その後UKで認定
まずEMAの集中審査手続(アクティブ日数210日でEU27にアクセス)で申請し、EUで承認取得後に、MHRAの国際承認認定手続(IRP)で英国の承認を申請します。IRPは、適格性に応じて、バリデーションから起算してRecognition A(暦日60日)またはRecognition B(暦日110日)に従います。申請者側のクロックストップを除けば、EU27と英国の双方のアクセスを得るまでの総期間は概ね270~320日です。英国の市場アクセスは、EUでの承認タイムラインにより遅れます。
MHRA–NICE アラインド・パスウェイによるUK先行
MHRA–NICE アラインド・パスウェイ(2026年4月開始)で申請し、販売承認とNHS償還推奨を同時に得たうえで、EUアクセスのためにEMAの集中審査手続を申請します。これにより英国をファーストローンチ市場に位置付けられ、逐次的なアプローチより3~6か月速くなる可能性があります。EUでの審査が進む間に収益化を開始できます。一方で、EMAのドシエとは別に、MHRA向け提出に投資する必要があります。
並行した二重申請
MHRA(英国のナショナル・プロシージャ)とEMA(集中審査手続)に同時に申請し、独立した並行審査トラックで進めます。両方の承認が得られる場合、両市場へのアクセスを最速で実現できます。その一方で、規制コストは最も高く、MHRAとEMA双方との対応のために別々の薬事体制を維持する必要があります。
市場アクセス戦略としての並行輸入
ジェネリック医薬品や特許切れ製品では、並行輸入ライセンスが、従来の販売承認要件を回避できる代替ルートとなります。
医薬品価格は欧州内で大きく異なります。同一の医薬品でも、英国の価格が一部のEU加盟国より大幅に高い場合があります。並行輸入は、ブレグジット後も英国が維持した既存の法的枠組みの中で、この価格差に対応するものです。
MHRAの並行輸入要件には、GMP基準で製造された製品であること、輸入・保管・販売をカバーする卸売業許可(Wholesale dealer’s licence)、製品ごとに必要なPLPIライセンス、そして再包装が必要な場合には、製品のアセンブリをカバーする製造許可が含まれます。
共通の起源要件を満たすシンプルPLPIであれば、承認は60~90日で得られる場合があります。このルートにより、EUで承認済みの既存ジェネリック医薬品について、英国固有の臨床試験や包括的な規制ドシエを実施せずに市場アクセスが可能になります。
市場参入に関する示唆
ブレグジット後の医薬品市場アクセスでは、両制度にまたがる規制手続のリテラシーがますます報われるようになっています。2026年4月に開始されるMHRA–NICE アラインド・パスウェイは、英国参入において、収益化までの時間や規制・償還の同時判断が、より大きいEU27市場への即時アクセスに勝る場合があるという、ファーストローンチのインセンティブ構造を生み出します。
並行輸入事業に関しては、ウィンザー・フレームワークの2025年1月1日実施により、GB/NIの二重ライセンス要件が撤廃され、英国の並行輸入市場の構造はより簡素化されました。
規制の複雑さは、いまや構造的な優位性として機能します。MHRAとEMAの双方の枠組みに深い専門性を築いた事業者は、特定の製品機会を見いだし、中央集権的なEU手続に最適化された大規模組織にとっては運用上難しい可能性のある承認ルートを、的確に選択し推進できます。
結語
英国とEUの医薬品市場アクセスのルートは調和しておらず、再調和に向かう兆しも見られません。ウィンザー・フレームワークは北アイルランドの規制上の位置付けを解決しましたが、英EU間の根本的な手続上の分岐には踏み込みませんでした。
企業は、EUの市場規模を最優先するのか、英国のスピード重視で最速上市を狙うのか、あるいは両制度の能力を構築して両市場を並行して追求するのかを決めなければなりません。規制の分断が進むほど、規模や従来の中央集権プロセスへの依存よりも、深い手続上の専門性を備えた事業者が有利になっていきます。
Author Profile(著者プロフィール)

氏名(Name):Vishal Chakravarty
役職(Title):Founder & CEO, NovaPharm Healthcare Ltd
連絡先(E-mail):vishal@novapharmhealthcare.com
Bio(略歴)
Vishal Chakravarty 氏は、英国を拠点とする医薬品流通企業 NovaPharm Healthcare Ltd(www.novapharmhealthcare.com)の創業者兼CEOです。同社は、ポスト・ブレグジット環境における並行輸入(パラレルインポート)と国境を跨ぐ市場アクセスに焦点を当てています。
同氏は、英国—EU 間の医薬品流通に関する規制コンプライアンス戦略を専門としており、MHRA のパラレルインポート・ライセンス制度、GDP(Good Distribution Practice:医薬品適正流通基準)、および二分化した規制体系下でのサプライチェーン最適化に精通しています。
業務の重点は、分岐した規制体系における実務的な規制適用に置かれています。
英国—EU の規制分岐および並行輸入に関する考察を、vishal.novapharmhealthcare.com で発信しています。
Series Introduction(連載イントロダクション)
ブレグジット後、英国とEUの医薬品規制体系の二分化は、両市場で事業を行う製薬企業の市場アクセス経路を根本的に再構成しました。本連載(全4回)は、ポスト・ブレグジットの規制環境を検討し、二重の規制体系をナビゲートするための実務的示唆を提供します。
- MHRA–NICE Aligned Procedure を含む、英国固有の規制ルートがもたらす戦略的優位性
- 規制分岐がコンプライアンスに与える影響
- ウィンザー・フレームワーク下における並行輸入の実務フレームワーク
- 国境を跨ぐ市場参入に向けた戦略的意思決定
Series Title(連載タイトル)
UK–EU Pharmaceutical Market Access and Compliance in the Post-Brexit Era(ポスト・ブレグジット時代における英国・EUの医薬品市場アクセスとコンプライアンス)
Articles(各回タイトル)
- Article 1 ブレグジット後の英国・EUにおける医薬品市場アクセスのルート
- Article 2 ブレグジット後の規制およびコンプライアンスの考慮事項
- Article 3 並行輸入の制度枠組みとリスクに関する考察
- Article 4 国境を跨ぐ市場参入に向けたコンプライアンス主導のアプローチ