安全性情報管理、新たな柱に‐切れ目ないサービス提供
イーピーエスは、医薬品開発業務で培ってきた強みを生かし、安全性情報管理業務をさらに拡大する。2018年に製造販売後調査(PMS)部門と安全性部門を統合した「リアルワールドエビデンス事業本部」のもと、治験から製販後における安全性情報に対応し、医薬品リスク管理計画(RMP)に基づいたPMS、リスク最小化策を一貫して受託し、切れ目のないサービスを提供している。治験での強靱な事業基盤を生かし、今後上市製品の増加が見込まれる再生医療等製品や医療機器の安全性情報管理にも対応していく。
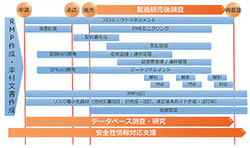
RMPサイクルに沿った各種サービス
同社は国内CRO最大手として、製薬企業や医療機器メーカーの開発業務をワンストップで受託してきた。今後に向けて強化する領域の一つが治験から製造販売後に至るまでの安全性情報管理である。18年4月のGPSP省令改正を契機にリアルワールドエビデンス事業本部を設置するなど大幅に刷新した。
製薬企業は収集した安全性情報を評価し、規制当局に報告する個別症例安全性報告(ICSR)の対応に追われている。イーピーエスでは同事業本部傘下に治験・製造販売後の安全性情報対応を行う「安全性情報センター」、PMSを支援する「PMSセンター」、医療情報データベース調査などを担う「RWE推進センター」を設置。治験から製販後まで安全性情報に対応し、ICSRをベースに付加価値の高いサービスを提供する。
医薬の様々なバックグラウンドを持つ専門家を揃えており、個々の製品の特性に応じて柔軟に必要な提案を行う。上流工程となるRMP作成支援では、ファーマコビジランス、医師、CTD作成者、薬剤疫学研究者などが部門横断的に安全性検討事項の設定から懸念事項を検討。安全性監視計画とリスク最小化策などの安全対策を提案し、RMP案作成につなげる。RMPに基づいた安全監視活動では、従来のデータマネジメント、統計解析の他、PMSモニタリングなどの周辺領域までカバーする。
医療情報データベース調査を活用した医薬品の安全性評価も特色の一つで、医療情報データベースの構築に取り組むアカデミアをサポートしてきた経験を持つ。生物統計や医学・薬学、薬剤疫学などの専門家に加え、医師主導臨床研究に特化したグループ会社「EPクルーズ」とも連携し、検討すべきリサーチクエスチョンに対するデザインを提案する。
再生医療等製品では安全性コンサルティングから医療情報データベース研究・調査を組み入れた計画策定、実施とサポート体制を整備している。医療機器についてもCROのサポート領域が開発から製販後に拡大し、開発段階から医療機器のリスクを想定した対策を講じている。
治験に強い会社から新たな事業の柱の一つとして安全性情報管理に強い会社を目指し、電子患者日誌やウェアラブル機器など新たなソリューションを導入した調査研究もサービス化を検討する。
イーピーエス
https://www.eps.co.jp/ja/index.html

















