京都大学大学院薬学研究科教授 松崎 勝巳

生体膜が関与する生命現象の理解には、膜を構成する蛋白質同士、蛋白質-脂質、脂質同士、さらには可溶性のペプチド・蛋白質も含めた複雑な動的分子間相互作用を解明することが不可欠である。本稿では、筆者の行った研究のうち、三つについて紹介する。
ヒトを含むあらゆる動植物は、病原微生物の侵入に対して抗菌性ペプチドを産生する。これら抗菌性ペプチドの細胞選択性・膜透過性亢進機構に関し、以下のメカニズムを解明した。
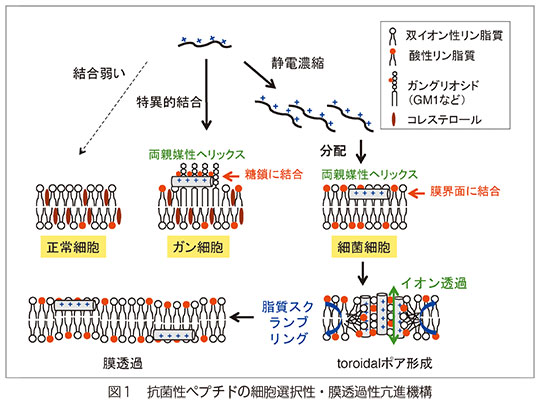
多くの抗菌性ペプチドは、塩基性・両親媒性であり、負電荷に富む細菌細胞膜表面に静電的に濃縮され結合した後、膜界面で両親媒性ヘリックス構造を取り、周りの脂質を抱き込んでtoroidalポアを形成する。これにより、膜透過性亢進と脂質のスクランブリングが惹起される。ポア崩壊時には、一部のペプチドが膜を透過する。また、癌細胞は正常細胞に比べ、ガングリオシドなどの発現により表面負荷電が大きいため、抗菌性ペプチドは抗癌剤としても利用できる。この時の分子認識は特異的であり、糖鎖部分に結合して両親媒性ヘリックス構造を取る(図1)
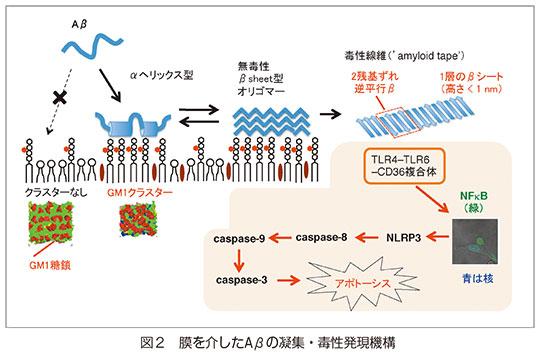
老人性認知症の大半を占めるアルツハイマー病の原因は、異常凝集したアミロイドβ蛋白質(Aβ)による神経毒性であると考えられている。神経細胞膜上でのAβの凝集・毒性発現機構に関し、以下の知見を得た。
コレステロールによって誘起されるGM1ガングリオシドのクラスターがAβの結合サイトを形成し、αヘリックス型→βシート型オリゴマー(約15量体)を経て、最終的に1層のβシート(in-register平行と2残基ずれの逆平行が混合)からなるテープ状のアミロイド線維を形成して、アポトーシスを引き起こす(図2)
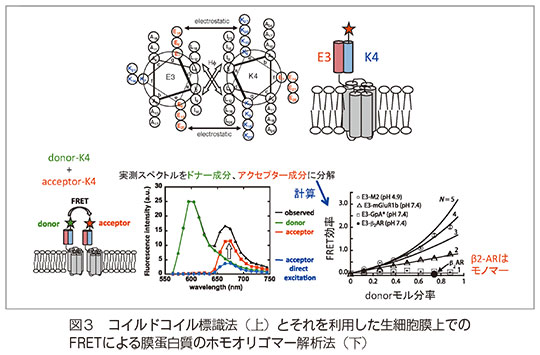
膜蛋白質の自己会合は機能発現にとって重要である。われわれは、生細胞膜上での膜蛋白質の自己会合を計測するため、コイルドコイル標識法を開発した。本法では、目的蛋白質に21残基からなるE3ペプチドを遺伝子上で融合して細胞に発現させ、これに化学合成した蛍光標識K4ペプチド(28残基)を添加して、目的蛋白質を蛍光標識する。強固(Kd~6nM)で迅速(1分以内)、そして細胞表面選択的な標識が可能である。
本法を用い、FRETによる生細胞膜上で膜蛋白質のホモオリゴマー解析法を開発し、クラスA GPCR、A型インフルエンザM2蛋白質、EGFR、グリコフォリンAの会合状態を解析した。その結果、β2アドレナリン受容体はモノマーで存在することが明らかとなった(図3)
以上のように、膜における複雑な動的分子間相互作用が、先天性免疫機構、認知症発症、細胞機能発現に関与していることが明らかとなった。今後は、これらの知見が医薬品開発につながることを期待している。



















