SaMD(プログラム医療機器)に関する産学官連携フォーラムが1日に都内で開かれ、SaMDの普及に向け、業界関連団体が承認審査制度や保険償還制度の見直しを訴えた。日本医療機器産業連合会(医機連)などは患者や医療従事者にいち早く届けるため、早期承認と暫定的な償還制度を要望。上市後のリアルワールドデータ(RWD)を活用し、有効性・安全性のみならず、医療経済性や利用者にとっての使いやすさなど改良・改善に資するデータを迅速に収集し、上市後のエビデンスに基づき再評価する仕組みに見直すよう求めた。
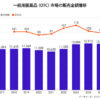
デジタル治療の承認・申請中の製品数は米国が27製品、欧州が32製品、日本が3製品にとどまり、開発製品数も米国が141製品、欧州が48製品、日本が12製品と大幅に少ない状況にある。
* 全文閲覧には 薬事日報 電子版 » への申込みが必要です。