Photo Credit: Adobe Stock
米食品医薬品局(FDA)は3月5日、Dexcom社の持続血糖測定器(CGM)であるDexcom Stelo Glucose Biosensor System(以下、Stelo)に対し、OTCでの販売許可を与えた。処方箋なしで入手できるCGMは米国初で、2024年夏までにオンライン販売が開始される予定。
Steloは、インスリンを使用していない18歳以上の2型糖尿病患者を対象とした機器である。ただしFDAはこの機器について、問題のある低血糖を伴う患者向けではないと警告し、「この潜在的に危険な病態についてユーザーに警告するようには設計されていない」と指摘している。
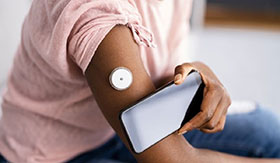
Steloは小型のウェアラブルセンサーで、上腕の裏側に装着すると、皮下に挿入された細いワイヤーが細胞間質液中のグルコースを連続して測定する。その情報は、ユーザーのスマートフォンにワイヤレスで送信される。この機器は最長15日間、交換せずに持続して使用できるという。
Dexcom社によると、米国にはインスリンを使用していない2型糖尿病患者が2500万人ほど存在している。同社では既に、こうした患者が使用できるCGMシステムであるDexcom G7を提供しているが、この機器を使用するためには処方箋を入手する必要があった。しかし、この機器のOTC版が登場すれば、状況は変わることになる。
FDAの医療機器・放射線保健センター(CDRH)長のJeff Shuren氏は、同局のニュースリリースで、「CGMは血糖値の監視に役立つ強力なツールとなり得る。今日の認可により、個人は医療提供者の関与なしにCGMを購入できるようになり、利用できる機会が拡大する。受診のしやすさや健康保険の利用の有無に関係なく、より多くの人が自身の健康に関する貴重な情報を得られるようになることは、米国における患者の健康の公平性を高める上で重要な前進だ」と述べている。
FDAに提出された臨床試験のデータによると、この機器は他の統合型CGMと同程度の性能を有することが示されている。有害事象としては、局所感染、皮膚刺激、疼痛や不快感などが報告されている。(HealthDay News 2024年3月6日)


















