京都大学大学院薬学研究科助教 南條 毅

生体内分子の一種であるペプチドはアミノ酸配列の違いにより多彩な生理作用を発揮することが知られているが、低い細胞膜透過性のために薬物標的に到達できず、生体内で速やかに分解されてしまうという性質から医薬品としての実現は困難とされてきた。
しかし最近になって、20種の天然型アミノ酸には含まれない異常アミノ酸や環状構造の導入によって、それらの課題を克服できることが明らかとなっており、特に10残基程度からなる中分子ペプチドはタフターゲットにも作用できる新たな創薬モダリティとして大いに注目を集めている。
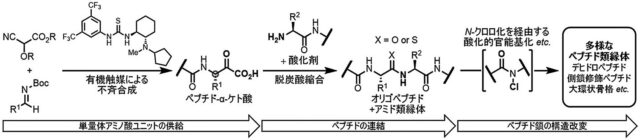
筆者はそのような非天然型中分子ペプチドを効率的に供給できる新規化学合成法の確立を目指して研究に取り組んできた。通常ペプチドを合成する際はアミノ酸を一つずつ順次連結していく必要があり、量的供給や誘導体合成を考えると理想的とは言えないアプローチである。加えて、異常アミノ酸残基の導入に際しては、対応するアミノ酸が入手容易とは限らず、1残基ずつの連結に向かない構造も存在する。そこで筆者は複数残基ずつ連結し得る新しいペプチド連結法としてα-ケト酸を用いた脱炭酸縮合法を開発すると共に、多彩な非天然型構造に応用できるアミノ酸ユニットの新たな調製法も確立した。
さらに、筆者は伸長後のペプチド鎖の構造改変に利用できる「N-クロロペプチド法」も開発した。既に手元にある親化合物をもとにした誘導体供給は魅力的なアプローチであるが、既存法ではペプチド側鎖に特定の官能基が必要であり、利用上の大きな制約となっていた。一方で、筆者の手法はペプチド主鎖を反応の足がかりとするため、アミノ酸残基の種類に依らず変換することが可能である。
本研究成果のように、合成アプローチの多角的な視点からの見直しは従来合成困難であった分子の供給を可能にし、それは創薬力にも直結する。今後も、創薬研究に貢献できる真に実用的な合成手法の実現を目指して研究に邁進していく予定である。