金沢大学医薬保健研究域薬学系教授 玉井 郁巳

トランスポーター(輸送体)は、駆動力の相違からSLC型とABC型に分類され、500種以上の分子が化合物の細胞膜透過に働く。多くの輸送体分子は選択的な栄養物・生理的物質調節を通じた生理的役割を有し、一部の分子は薬物など多様な生体異物も幅広く認識することで薬物動態に関わる。
しかし、このような理解が進んだのは2000年以降であり、本研究ではここに至る輸送体の生理的・薬物動態的意義を明確にするため、多くの輸送体を対象に検討を進めてきた。その一部を紹介する。
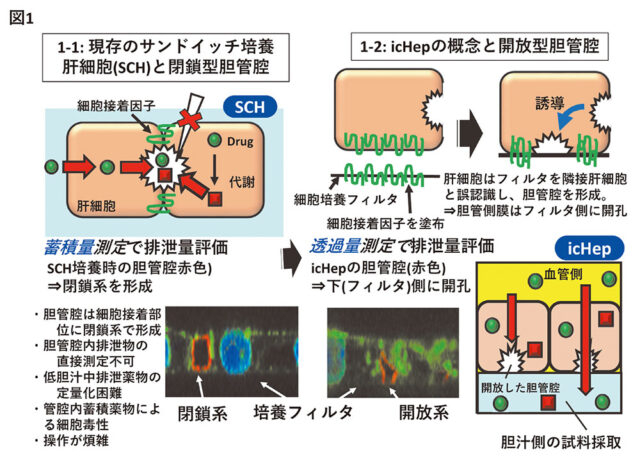
薬物動態上重要な肝動態は、血中から肝細胞内への取り込み、細胞内薬物代謝および輸送体を介した胆汁中排泄過程を含み、全過程の評価が必要だが、胆汁中排泄評価手法は不十分であった。既存のサンドイッチ培養細胞(SCH)法では培養系への薬物の蓄積量から胆汁中移行性を評価するが、胆管腔が閉鎖系となるため胆汁中排泄物を採取できないことや、操作が煩雑などの課題がある(図1-1)
そこで、胆管腔は肝細胞間に形成されることに着目し、汎用される経細胞輸送測定により胆汁中排泄を評価する手法icHep(Induced open-form bile Canaliculus HEPatocytes)を樹立した(図1-2)。具体的には、胆管腔形成に必要な肝細胞接着因子として見出したclaudinsを合成、培養フィルタ上に塗布し、胆管腔を培養フィルタ上に誘導できた。icHepは輸送体発現を維持し、両膜の輸送体を介した胆汁中排泄を経細胞輸送測定により評価できる簡便な方法となる。icHepでの経細胞輸送性から算出した胆汁中排泄クリアランス(CLbile)はin vivo CLbileと相関し、胆汁中排泄を含む簡便な薬物および代謝物のinvitro肝動態解析手法となり、動物試験代替法としても有用である。
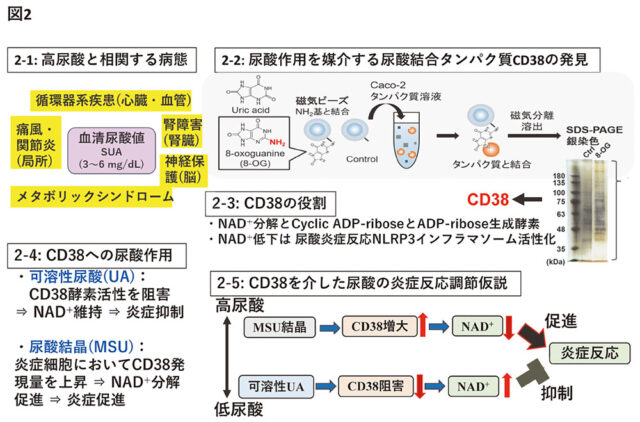
生理的物質輸送体として着目した尿酸について次に紹介する。血清尿酸値(SUA:Serum Uric Acid)の変動は、痛風以外にも多様な疾患と関連するため正常値の維持が望まれる(図2-1)が、降圧薬などの医薬品が副作用としてSUAを変動させ、影響が大きい場合はポリファーマシーのリスクがある。降圧薬やサリチル酸によるSUA変動は、腎尿酸再吸収輸送体URAT1の阻害あるいは活性化によって説明される。
一方、SGLT2阻害薬が共通して示すSUA低下作用は、薬効により増大した尿糖が腎尿酸輸送体への作用を介して尿酸の尿中排泄を促進することで説明される。本現象は、糖尿病悪化がSUA低下と相関するという臨床データとも一致することで裏付けられる。
また、尿酸動態に糖が影響するという生理的物質間の相互作用は、SUA変動に伴う他の物質動態異常を通じた生理現象変動を示唆する。尿酸は多様な疾患と相関するため、新たに尿酸結合蛋白質が尿酸作用を媒介するという仮説を考えたところ、CD38を尿酸の作用標的として見出した(図2-2)。CD38は主たるNAD+分解酵素であるが(図2-3)、可溶性尿酸はCD38活性を抑制し、尿酸結晶はCD38発現を増大させ、尿酸の存在形態によって相反する作用を示す結果を得た(図2-4)。NAD+は炎症反応を調節するため、尿酸輸送体はSUAを制御することでCD38を通じて炎症反応を調節する可能性が示された(図2-5)
研究成果の一部として、invitro胆汁中排泄評価法ならびに尿酸輸送体を介したSUA変動と尿酸作用を説明するCD38仮説を記載した。輸送体は物質の動態制御を通じて薬効・毒性・生理作用・病態に深く関わり、その理解を深めることは生理現象の理解の促進と創薬・医療への貢献が期待できる。