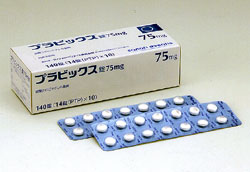
サノフィ・アベンティスは8日、世界的に広く用いられている大型製品で、抗血小板剤の「プラビックス」(一般名:硫酸クロピドグレル)を発売した。動脈での血栓凝集や形成を抑制する薬剤で、日本では「虚血性脳血管障害(心原性脳塞栓症を除く)後の再発抑制」の適応を取得した。同社は、安全性モニタリングを重視し、当面は専門医を中心に慎重な販売促進を行うとしている。
日本では75mg錠(薬価289・60円)と25mg錠(同114・50円)の2規格を発売した。基本的には75mgを1日1回投与、年齢、体重、症状などに応じて50mgを1日1回投与する。
既に欧米ほか85カ国で販売されており、同社としても成長を支える主力品という位置づけで、2005年には世界で20億ユーロ(サノフィ・アベンティス分)を売り上げている。
そのため多くの症例で有効性、安全性の蓄積があるが、同社は広く使われる薬剤であることなどから、日本の患者に対する安全性は日本人データで確立する必要があると判断し、施設や医師を限定した納入はしないが、脳梗塞治療の専門医を中心に安全性情報の収集に力点を置いて販促活動を展開することにした。当面は「大々的なプロモーションは行わない」として、目標売上高は明らかにしていない。
販促は、同社の300人程度の専任のMRと共に、共同販促を行う第一製薬のMRと併せ約1000人体制で行う。6カ月の市販直後調査で全例モニターを行い、安全性の確認を経て、順次、販売拡大につなげていきたい考えだ。
承認時までの調査1881例で報告された副作用は571例(30・4%)で、主な症状は皮下出血41例(2・2%)などの出血傾向だった。重大な副作用の一つとして、頻度は不明だが、血栓性血小板減少性紫斑病(TTP)を添付文書に記載した。
仏本社は「プラビックスの上市が日本の事業の転換期となる」と、市場拡大の契機として期待を寄せている。発売の発表も仏本社が行った。急性心筋梗塞などの「急性冠症候群」(非ST型)の適応を狙った開発が国内で進められており、現在PIIIにある。