徳島大学大学院医歯薬学研究部教授 大高 章

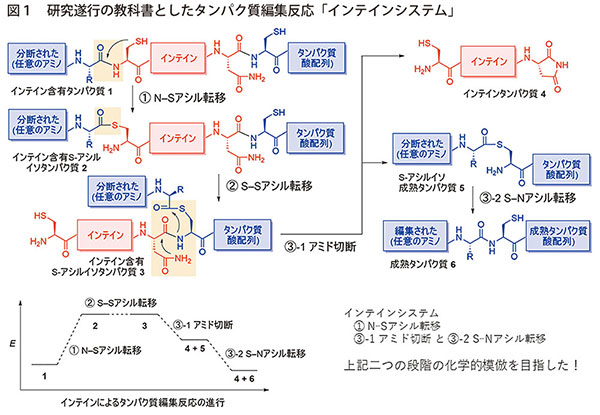
細胞膜にある膜タンパク質は、受容体やイオンチャネルとして機能し、生体恒常性維持に不可欠である。これを化学合成したいというのが、ペプチド・タンパク質合成化学者にとっての夢の一つである。私もこの夢を抱き、実現へのヒントをタンパク質自己編集反応である「インテインシステム」に求めた(図1)。これは、三つのアシル基転移反応が連続的に起こり、インテイン含有タンパク質からインテイン配列が脱落するものである。本システムのN-Sアシル転移段階(図1[1])およびアミノ酸側鎖が介在したアミド切断とS-Nアシル転移(図1[3])を化学的に模倣し、夢に近づこうと考えた。その過程でペプチド・タンパク質化学発展に資する方法論の創出に至ったので紹介する。
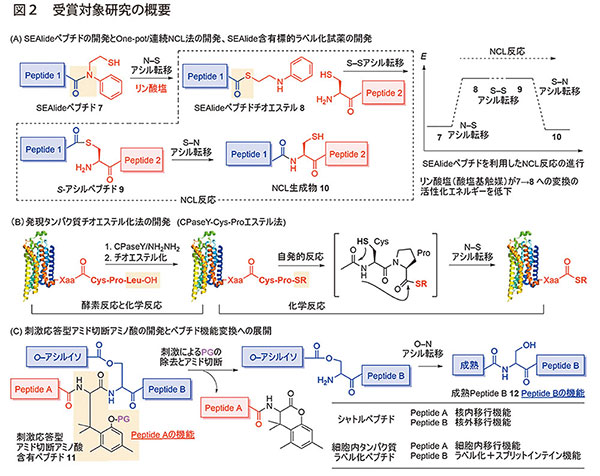
SEAlideペプチドの開発とOne-pot/連続NCL法の開発、SEAlide含有標的ラベル化試薬の開発
チオエステルを用いるNCL法は、タンパク質合成に必須のアミド形成法であるが、チオエステル合成、そして長鎖タンパク合成のためNCL法の同一反応容器(One-pot)での連続的実施が困難であった。N-Sアシル転移段階を模倣したSEAlideペプチド7を開発、リン酸塩によるN-Sアシル転移促進を明らかにし、前述の隘路拡幅に努めた。また、チオエステル体への変換の酸塩基触媒(リン酸塩)による促進に着目、タンパク質表面を酸塩基触媒クラスターと見なし、タンパク質への結合により活性化されるSEAlide含有タンパク質ラベル化試薬の開発を行った(図2A)
発現タンパク質チオエステル化法の開発(CPaseY-Cys-Proエステル法)
チオエステルはタンパク質合成の必須合成中間体である。前述のSEAlideは人工ユニットを利用したチオエステル調製であるが、天然アミノ酸からなる発現タンパク質を自在にチオエステルに変換できれば、NCL法を利用し、多様な人工タンパク質の半合成が可能となる。化学的手法を基盤に本課題に挑戦、Ni錯体形成およびS-シアノ化を利用した化学方法論2種類とカルボキシペプチダーゼY(CPaseY)による酵素反応と化学反応を融合したCPaseY-Cys-Proエステル法、計3種の方法論を開発した(図2B)
刺激応答型アミド切断アミノ酸の開発とペプチド機能変換への展開
ペプチド結合は、酸塩基あるいは酵素処理により切断される。アミド結合切断シグナルとならない刺激を、アミド切断シグナルへと変換するアミノ酸の開発を行った。フェノール性水酸基に、その反応性をマスクする保護基を導入、種々刺激での保護基切断をトリガーとする水酸基の隣接アミドへの求核攻撃によるアミド切断を達成した。この刺激応答型アミド切断アミノ酸を利用し、標的タンパク質を選択的に可視化するトレーサブルリンカーを開発した。
さらに、本アミノ酸とアシル転移反応を融合し、ペプチド機能変換への展開として核から細胞質に移行するシャトルペプチドや細胞内タンパク質修飾試薬の開発に成功した(図2C)
膜タンパク質を合成したいとの思いから、自然にヒントを求め、そこに派生した研究である。膜タンパク質合成は未達成だが、紹介した成果がペプチド・タンパク質、さらには関連研究領域の発展に寄与できれば望外の幸せである。なお、紹介した研究の大半は2005年徳島大学への異動を契機に開始したものである。
研究に携わってくれた関係者すべてに、紙面を借りて感謝したい。