遺伝子治療は病気の原因となる遺伝子そのものを修復・置換することで治療する革新的な療法です。なお、厚生労働省の指針では「遺伝子治療等」を、[1]遺伝子又は遺伝子を導入した細胞を人の体内に投与すること、[2]特定の塩基配列を標的として人の遺伝子を改変すること、[3]遺伝子を改変した細胞を人の体内に投与すること――と定義しています。
これまで根治が難しいとされた遺伝性疾患や難治性疾患に対し、新たな治療の可能性を切り拓くものとして注目されています。2025年には複数の新しい遺伝子治療薬が国内外で承認され、臨床応用が加速しています。本記事では、遺伝子治療の基礎知識からその歴史的歩み、最新の動向、そして今後の展望と課題までをわかりやすく解説します。
遺伝子治療の基礎知識
遺伝子治療は患者の細胞に正常な遺伝子を導入し、欠陥遺伝子の機能を補ったり修正したりする治療法です。大きく分けて次のようなアプローチがあります。
| 体内直接投与 (in vivo) |
治療用遺伝子を運ぶベクター(ウイルスベクターやLNP(脂質ナノ粒子)など)を患者の体内に直接投与し、標的組織の細胞内に遺伝子を送り届けます。例として、ウイルスベクターを眼や筋肉など患部に注射して遺伝子を導入する方法があります。 |
|---|---|
| 体外操作 (ex vivo) |
患者の細胞(例: T細胞や幹細胞)を一度体外に取り出し、機能遺伝子を導入した後に細胞を体内に戻す方法です。例えばCAR-T細胞療法では、患者自身のT細胞にがん攻撃遺伝子(キメラ抗原受容体)を組み込んで戻すことで白血病などを治療します。 |
| 遺伝子編集 | 従来の「遺伝子を補う」手法に加え、CRISPR-Cas9などで直接DNA配列を書き換える先端的なアプローチも登場しています。これは病因遺伝子を狙って修復する「遺伝子を治す」治療法で、将来的な発展が期待されています。 |
遺伝子治療薬(遺伝子治療製品)とは、遺伝子や遺伝子を運ぶベクターそのもの、または遺伝子改変した細胞が「薬(製品)」になる治療を指します。
・多くは1回投与など「治療設計」が従来薬と異なる
・製造・品質管理や長期フォローアップが重要になりやすい
・承認状況は公的な一覧(NIHSや規制当局の公開リスト)で確認できる
NIHSは日米欧で承認された遺伝子治療製品を一覧化しており、日本で承認された例も同資料で確認できます。
これらの方法により、遺伝子治療は遺伝性疾患のみならず、がんなどの後天的疾患にも応用が広がっています。以下では、その発展の歩みを振り返りましょう。
| 1990年: 世界初の遺伝子治療成功 |
米国で4歳の女児に対するADA欠損症の遺伝子治療が実施され、遺伝子治療の初症例が成功しました。 |
|---|---|
| 1999年: 治験死亡事故で開発停滞 |
遺伝子治療の臨床試験中に被験者が死亡し、安全性への懸念から研究は一時停滞しました。また一部の試験では白血病の発症も報告され、当時の課題が浮き彫りとなりました。 |
| 2010年代: 技術革新と復活 |
ウイルスベクター投与や手法の改良により、パーキンソン病や血友病などで有望な治療効果が次々確認されました。2012年にはCRISPR/Cas9など画期的なゲノム編集技術が登場し、研究開発が急速に加速します。 |
| 2022~2024年: 相次ぐ新薬承認 |
「承認ラッシュ」と呼ばれる時代に突入。2022年に血友病A用Roctavian、血友病B用Hemgenixが承認され、翌2023年にはデュシェンヌ型筋ジストロフィーにElevidys、鎌状赤血球症にCasgevyとLyfgeniaが相次いで米国で承認。さらに2024年春には小児難病MLDに対するLibmeldyも承認され、わずか3年で7製品もの遺伝子治療薬が市販化されました。 |
遺伝子治療の歴史的歩み
こうした歴史を経て、遺伝子治療は研究段階の夢の治療から実用段階の現実の治療へと大きく歩みを進めました。1990年代の黎明期には期待と挫折を経験しましたが、2010年代の技術進歩により復活し、2020年代前半には立て続けに革新的治療が誕生する時代となっています。
2025年時点の最新動向
2025年現在、遺伝子治療の実用化は世界的に加速しています。米FDAは細胞・遺伝子治療の承認製品一覧(Approved Cellular and Gene Therapy Products)を公開しており、承認済み製品は公式ページで確認できます(同ページには更新日が示されています)。英国でもMHRAが2023年11月に世界初のCRISPR遺伝子編集薬「Casgevy」を承認し、NICEの承認を経てNHSでの提供が進み、2024〜2025年にβサラセミア/鎌状赤血球症で導入が始まりました。疾患領域も広がり、希少疾患のみならずより多くの患者がいる病気への適用も進んでいます。欧州ではEMAが年次の承認推奨のまとめを公開しており、2025年の概要では希少疾患領域の例として、栄養障害型表皮水疱症に対する外用ゲル型の遺伝子治療にも言及しています。
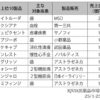
日本における承認状況も徐々に進展しています。現時点で国内で承認された遺伝子治療薬はまだ限られますが、対象疾患の幅は着実に広がっています。例えば脊髄性筋萎縮症(SMA)に対する「ゾルゲンスマ」、網膜ジストロフィー(RPE65変異)に対する「ルクスターナ」といった希少疾患向け遺伝子治療薬が承認済みです。さらに2025年にはデュシェンヌ型筋ジストロフィー向け遺伝子治療薬「エレビジス」(Elevidys)が条件付き承認されましたが、安全性懸念により一時的に出荷停止措置が取られています。NIHSの整理(2025年12月更新)では、日本で承認された遺伝子治療製品の例として、ゾルゲンスマ(SMA)、ルクスターナ(RPE65変異網膜ジストロフィー)、エレビジス(デュシェンヌ型筋ジストロフィー、条件・期限付き承認)、バイジュベック(栄養障害型表皮水疱症)などが挙げられています。
一方、がん領域では遺伝子改変T細胞療法(CAR-T細胞療法)の承認が相次いでいます。日本でも白血病・リンパ腫向けの「キムリア」「イエスカルタ」、多発性骨髄腫向けの「ブレヤンジ」「アベクマ」「カービクティ」など5製品が実用化されました。これらは患者自身の免疫細胞に遺伝子操作を施し、がんを攻撃させる細胞療法であり、広義の遺伝子治療の一形態と言えます。
海外の最新動向としては、血友病A/B、鎌状赤血球症、メタクロマチック白質ジストロフィー(MLD)など、かつて「治療は夢」とされた難病に対して遺伝子治療薬が続々と登場しています。例えば、ヘモフィリア(血友病)向けの治療薬はA型/B型それぞれ世界初の遺伝子治療薬が2022年に承認されました。鎌状赤血球症やβサラセミアといった血液の遺伝病にも、遺伝子治療による根治的アプローチが実現しています。加えて、デュシェンヌ型筋ジストロフィー(小児の進行性筋疾患)に対する治療薬が史上初めて承認され、部分的ながら患者の筋機能維持に効果を示しています。
このように遺伝子治療は「研究段階」から「臨床の現場」へと着実に降りてきている状況です。臨床試験の数も世界的に増加しており、遺伝子治療の開発動向は、NIHSが「承認済み」「承認申請中・第3相」「国内開発段階」などの品目リストを定期更新しており、主要品目を俯瞰できます。製薬各社も遺伝子治療分野への参入を加速させており、巨額の投資や企業買収、提携によってパイプラインを強化する動きが活発です。例えば、大手製薬企業によるバイオベンチャーの買収(数百億~数千億円規模)や、AI技術を活用したベクター開発ベンチャーとの提携などが相次ぎ、業界再編も進んでいます。
もちろん、課題も残されています。一部の治療では高用量ベクターの投与に伴う副作用(肝障害など)が報告され、長期的な安全性モニタリングの重要性が認識されています。規制当局も安全対策を強化しており、米FDAは投与後15年に及ぶ長期追跡調査を義務付ける指針を打ち出し、英MHRAもATMP(先端治療)に対して、リスクに応じた長期フォローアップ計画(RMPに基づく観察・追跡)を求めており、それでもなお、遺伝子治療開発の勢いは衰えていません。
今後の展望と課題
遺伝子治療の未来は非常に明るい一方で、克服すべき課題も存在します。技術的にはより多くの疾患への適用、投与法の改善、そして安全性・有効性の向上が引き続き目標となります。産業面では製造プロセスの標準化とコスト低減が大きなテーマです。社会面では、治療の公平な提供方法や倫理的な問題に対する議論が重要になってきます。
技術的展望としては、より高度な遺伝子編集療法(ゲノム編集)や次世代ベクターの開発が挙げられます。CRISPRを用いた体内直接の遺伝子編集治療は臨床試験で成果を報告していますが、現時点では承認されたのは体外編集(ex vivo)であり、体内直接編集(in vivo)はまだ臨床試験段階です。将来的には一度の注射で遺伝子異常を修正できる治療も現実味を帯びています。また、一つのウイルスベクターでは運べない大型遺伝子を運ぶレンチウイルスベクターや、繰り返し投与可能な非ウイルスベクター(ナノ粒子など)の開発も進んでおり、疾患に応じた最適なデリバリー技術を選択する「マルチモダリティ戦略」が主流になりつつあります。これにより、今後は難治性の遺伝子疾患だけでなく、生活習慣病や一般的ながんなどにも遺伝子治療の応用が検討される可能性があります(※ただし、現時点では臨床応用の見通しは不透明です)。
規制当局の対応と市場制度も重要な展望です。各国で遺伝子治療の審査体制が整備されつつあり、米国FDAでは2023年に「治療製品局(OTP)」を新設して細胞・遺伝子治療専門の審査部署を作るなど、体制強化が図られています。英国ではMHRAがILAP(Innovative Licensing and Access Pathway)を通じて開発初期からの伴走支援を行い、HRAとの“Combined Review”により規制・倫理の一体審査を進めています。欧州でも条件付き承認制度を活用し、患者への早期アクセスと慎重な長期フォローの両立を模索しています。価格面では、超高額薬剤に対するアウトカム(治療結果)に連動した支払いモデルが試行されています。例えば、効果が十分発現しない場合に支払いを免除・減額するといった成果連動型の契約です。これらの新しい取り組みが軌道に乗れば、遺伝子治療の普及を妨げるコスト障壁を下げ、より多くの患者が恩恵を受けられる可能性があります。
しかし、依然として解決すべき課題が存在します。特に以下のような倫理的・社会的論点は、遺伝子治療が「当たり前の医療」になるために議論が欠かせません。
| 治療の境界 | 遺伝子改変の「善い用途」と「悪い用途」を誰がどのように線引きするのか。何を正常とみなし、何を疾患として介入すべきかという定義も簡単ではありません。 |
|---|---|
| 公平性とアクセス | 遺伝子治療は極めて高額であるため、富裕層だけの特権医療とならないかが懸念されています。医療保険制度や国の支援によって、すべての患者が平等にアクセスできる仕組みづくりが必要です。 |
| 多様性の尊重 | 仮に遺伝子治療で多くの疾患や障害が是正できる社会になると、社会が多様な個性や障害を受容しなくなる危険も指摘されています。遺伝子治療が「望ましい人間像」の押し付けにつながらないよう注意が必要です。 |
| 将来世代への影響 | 生殖細胞系列への遺伝子治療、つまり卵子や精子、受精卵に対する遺伝子改変は、改変が次世代に受け継がれるため極めて慎重な扱いを要します。将来生まれてくる子孫に予期せぬ影響を与える可能性や、本人の同意が得られないことから、現時点では人に対する生殖系列編集は世界的にも厳しく規制されています。2018年に中国で起きたヒト受精卵のゲノム編集実施は国際的な非難を呼び、改めて倫理規範の重要性が認識されました。 |
このように遺伝子治療は医学的革新であると同時に社会の在り方にも影響を及ぼし得る技術です。安全性確保や価格の妥当性、倫理指針の整備など、乗り越えるべきハードルがありますが、各国の行政・研究機関、企業、患者団体が協力して少しずつ環境整備が進められています。
また、開発推進の体制という点では、製薬企業とCRO(医薬品開発受託機関)の連携が一層重要になるでしょう。遺伝子治療の開発・臨床試験には高度に専門的なノウハウと煩雑な規制対応が伴います。近年では、従来のアウトソーシングを超えて「開発の包括的パートナー」としてCROに期待が寄せられており、臨床設計から規制戦略、市販後の商業展開までトータルに支援できる体制づくりが進んでいます。遺伝子治療に強みを持つCROとの協働は、治験の効率化や品質確保に大きな助けとなり、革新的治療の迅速な患者への届け出を可能にすると考えられます。
まとめ
遺伝子治療は、患者の遺伝子レベルに働きかけることで根治を目指す新時代の医療です。歴史的には試行錯誤の連続でしたが、技術革新とともに着実に進歩し、近年では実際に治療現場で成果を挙げる段階に入ってきました。2025年現在、国内外で複数の遺伝子治療薬が承認され、これまで治せなかった難病に希望の光をもたらしています。一方で、安全性の監視、医療費や社会的受容性といった課題も浮上しており、技術と社会の両面から解決策を模索する必要があります。
それでも、遺伝子治療が持つポテンシャルは計り知れません。患者さん本人の遺伝子を「治療」に使うという発想は、医療のパラダイムを大きく転換するものです。今後5年でさらに多くの疾患に遺伝子治療が「当たり前」に提供される未来も現実味を帯びています。その実現のためには、研究開発者、医療従事者、規制当局、CROパートナー、そして社会全体が協力し、安全で公平な遺伝子治療の普及に向けた仕組み作りを進めていくことが重要です。
最後に、遺伝子治療は患者にとっての新たな希望であると同時に、我々に責任ある技術活用を問いかける存在でもあります。未来を担う画期的な治療法として、その恩恵を一人でも多くの人が享受できるよう、課題を乗り越えつつ着実に前進していくことが期待されます。子供の頃には夢物語だった「遺伝子で病気を治す」時代が、目前まで来ています。その展望を胸に、今後の遺伝子治療の発展を見守りたいと思います。
遺伝子治療の最新情報リンク集
1. 承認済み遺伝子治療薬一覧(2000年以降)
日本・米国・EUで承認された遺伝子治療薬の一覧リンクです。
-
国立医薬品食品衛生研究所(NIHS)「遺伝子治療等製品の承認状況」
日本で承認された遺伝子治療製品の一覧を確認できます。
URL: https://www.nihs.go.jp/ -
FDA Gene Therapy Approvals
米国FDAによる遺伝子治療製品の承認情報を掲載しています。
URL: https://www.fda.gov/vaccines-blood-biologics/cellular-gene-therapy-products -
EMA Advanced Therapy Medicinal Products
欧州医薬品庁による先進医療製品(ATMP)の承認情報です。
URL: https://www.ema.europa.eu/en/human-regulatory/overview/advanced-therapy-medicinal-products-overview
2. 開発中パイプライン情報
第3相試験・承認申請中の遺伝子治療製品情報を確認できます。
-
NIHS「開発中の再生医療等製品リスト」
日本国内で開発中の遺伝子治療製品の情報を網羅しています。
URL: https://www.nihs.go.jp/ -
ClinicalTrials.gov(遺伝子治療 試験検索)
世界中の臨床試験情報を検索できる米国NIHのデータベースです。
URL: https://clinicaltrials.gov/
3. 製造・開発支援企業(CDMO)
遺伝子治療製品の製造を支援する企業情報です。
-
再生医療イノベーションフォーラム(FIRM)CDMO企業リスト
国内のCDMO企業の一覧と対応モダリティが確認できます。
URL: https://firm.or.jp/ -
経産省「再生医療関連産業マップ」
再生医療関連産業の構造や企業情報をまとめたマップです。
URL: https://www.meti.go.jp/
4. 規制・承認情報
日本・米国・EUの規制情報と承認品目のデータベースです。
-
PMDA 承認品目一覧
日本の医薬品・再生医療等製品の承認情報を確認できます。
URL: https://www.pmda.go.jp/ -
FDA Biologics License Applications
米国FDAによる生物製剤の承認申請情報です。
URL: https://www.fda.gov/vaccines-blood-biologics/biologics-license-applications -
EMA ATMPガイドライン
欧州医薬品庁によるATMP関連の規制ガイドラインです。
URL: https://www.ema.europa.eu/en/human-regulatory/research-development/advanced-therapy-medicinal-products/guidelines
5. 業界動向・企業情報
遺伝子治療市場の動向や企業の開発状況を把握できます。
-
Mordor Intelligence「Gene Therapy Market」
遺伝子治療市場の成長予測や主要企業の分析レポートです。
URL: https://www.mordorintelligence.com/industry-reports/gene-therapy-market -
Evaluate Pharma「Gene Therapy Pipeline」
製薬企業の遺伝子治療パイプライン情報を提供しています。
URL: https://www.evaluate.com/
6. 開発支援・CRO情報
臨床試験や開発支援を行うCRO(開発業務受託機関)の情報です。
-
日本CRO協会(JCROA)
日本国内のCRO企業の一覧や業界情報を提供しています。
URL: https://www.jcroa.or.jp/ -
ACRO(Association of Clinical Research Organizations)
グローバル主要CROの会員情報を確認できます。
URL: https://www.acrohealth.org/members -
MHRA「Phase I 認定ユニット一覧」
英国の初期臨床試験施設の認定リストです。
URL: https://www.gov.uk/government/publications/clinical-trials-unit-approval-phase-i-units -
Richmond Pharmacology(UK)
英国の初期臨床試験施設で、MHRA認定を受けたユニットを運営しています。
URL: https://www.richmondpharmacology.com/ -
CMIC Group(日本)
細胞・遺伝子治療領域に特化した開発支援サービスを提供しています。
URL: https://www.cmicgroup.com/ -
EPS(EPSグループ)
日本およびアジア地域で臨床試験支援を行うフルサービスCROです。
URL: https://www.eps.co.jp/ -
ICON(Cell & Gene Therapies)
遺伝子治療領域に特化した専門チームと豊富な試験実績を有するグローバルCROです。
URL: https://www.iconplc.com/solutions/therapeutics/cell-and-gene-therapy/ -
Parexel(Cell & Gene Therapies)
規制当局出身者を擁する専門チームによる遺伝子治療支援を提供しています。
URL: https://www.parexel.com/solutions/therapeutic-expertise/cell-and-gene-therapy -
Medpace(Cell & Gene Therapy)
130件以上の遺伝子治療試験実績を持つグローバルCROです。
URL: https://www.medpace.com/therapeutic-expertise/cell-and-gene-therapy/