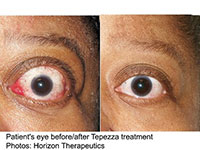
米食品医薬品局(FDA)は1月21日、甲状腺眼症の初の治療薬となるteprotumumab(テプロツムマブ、商品名Tepezza;国内未承認)を承認したと発表した。甲状腺眼症はまれだが発症すると失明するリスクもある。
teprotumumabは、インスリン様成長因子I受容体(IGF-IR)を阻害するヒトモノクローナル抗体だ。承認の根拠となる臨床試験を率いた米シーダーズ・サイナイ医療センター眼科部門の外科教授であるRaymond Douglas氏によると、甲状腺眼症に対する現行治療は支持療法に過ぎず、眼症状によるQOL(生活の質)低下は防げなかった。そのため、「teprotumumabの登場は、甲状腺眼症の治療にパラダイムシフトをもたらすだろう」と同氏は期待を示している。
Douglas氏によれば、甲状腺眼症では眼球の奥の組織に炎症が起こり、眼球が押されて突出する。また、炎症による結膜浮腫によって視神経が圧迫され、視力にも問題が生じることがある。
一方、米国甲状腺学会(ATA)によると、甲状腺眼症はグレーブス病(バセドウ病)が原因で甲状腺機能が亢進した患者に合併することが多い。甲状腺眼症では眼の充血やまぶたの腫れ、眼がゴロゴロするなどの症状のほか、ドライアイや複視、光線過敏症などが引き起こされることもある。最も特徴的な症状は眼球突出で、眼を完全に閉じられなくなるケースもあるという。
甲状腺眼症はまれな疾患であることから、FDAはteprotumumabをオーファンドラッグ(希少疾病用医薬品)に指定したほか、承認を迅速化させるため、優先審査とファスト・トラック、ブレークスルー・セラピーにも指定していた。
FDAは今回、計約170人の活動期甲状腺眼症患者を対象とした2件の臨床試験結果に基づき、teprotumumabを承認した。Douglas氏が率いた臨床試験の結果は「New England Journal of Medicine」1月23日号に発表された。最新の試験では83人の患者を対象に、teprotumumab群またはプラセボ群にランダムに割り付けた。薬剤は3週間に1回、21週間にわたり静脈内投与した。なお、teprotumumabの静脈内投与には約1時間かかるという。
その結果、teprotumumab群では2回目の投与で効果が現れ始めた。また、24週の時点で眼球突出に対する効果(突出が2mm以上減少)が認められた患者の割合は、プラセボ群の10%に対してteprotumumab群では83%と有意に高かった(P<0.001)。また、teprotumumab群では全体的な効果もプラセボ群に対して高く(78%対7%)、QOLも良好であったほか、複視に対する効果は手術に匹敵するものであった。
さらに、teprotumumabの副作用は少なく、忍容性は良好であった。最も頻度の高い副作用は、筋肉のけいれんと嘔気、脱毛、疲労であった。
この臨床試験には関与していない米マウントサイナイ・ニューヨーク眼科耳鼻科病院のHarsha Reddy氏は、「teprotumumabの承認により、甲状腺眼症を早期に治療し、眼の悪化防止を目指せる治療選択肢を初めて手に入れることができた。この薬は甲状腺眼症治療に革命を起こすだろう」と述べている。(HealthDay News 2020年1月22日)
(参考情報)
Abstract/Full Text
https://www.nejm.org/doi/full/10.1056/NEJMoa1910434
Press Release
https://www.fda.gov/news-events/press-announcements/fda-approves-first-treatment-thyroid-eye-disease

















