東北大学大学院薬学研究科講師 櫻井 遊

癌組織は、癌細胞およびその他の間質細胞により形成される腫瘍微小環境によって構成されており、これらの微小環境を構成する細胞は各々が癌細胞の成長・悪性化を増長している。微小環境内の中でも血管は、正常組織には見られない異常な血管の新生により、癌細胞に酸素や栄養などの成長に必須の因子を供給し、腫瘍の成長に重要な役割を果たしている。このことから、腫瘍組織中の血管の機能の制御は、癌細胞そのものを標的とする従来の治療法とは異なる新たな治療原理になると期待される。
私たちは、腫瘍血管における遺伝子発現の制御のためにsmall interfering RNA(siRNA)を用いた。siRNAは細胞質内で自身と相補的な配列を有するmessenger RNAを分解し、その遺伝子発現を抑制するRNA干渉を引き起こす。siRNAは従来の低分子化合物と比較すると体内で不安定であり、また細胞膜を透過できないことから目的の細胞内へと送達するためのドラッグデリバリーシステムが必要となる。本研究では、siRNAを生体内での分解から保護し細胞選択的に送達するために、脂質ナノ粒子への種々の機能素子の表面修飾による核酸動態制御技術の開発、そして本技術を用いて血管を中心とする腫瘍微小環境制御による癌治療を目指した。
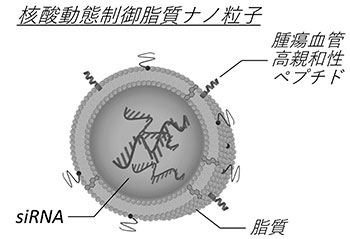
脂質ナノ粒子に細胞指向性を持たせるために粒子表面を腫瘍血管に親和性を有するペプチドで修飾し、腫瘍血管標的型ナノ粒子を構築した。本粒子を癌移植モデル動物に投与したところ、腫瘍血管選択的に集積した。また、粒子に搭載したsiRNAによって腫瘍血管マーカー遺伝子を有意に抑制することに成功した。さらに、癌の血管を異常たらしめている原因遺伝子に対するsiRNAを搭載した粒子の投与によって、その後に投与した抗癌剤の腫瘍内拡散性が増加し、薬理効果が飛躍的に向上した。
今回確立した細胞標的化技術は、今後脂質ナノ粒子を癌以外の任意の臓器・細胞へと送達させるための基盤技術へと発展させていきたい。















