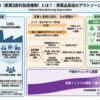
日本製薬工業協会医薬品評価委員会PMS部会の調査によると、2001年度から05年までの5年間に承認された、延べ172成分(部会審議品目、効能追加含む)で、承認条件が課されたのは約4割の68成分だった。通常品目は年度によ
“希少疾病”を含む記事一覧
薬事・食品衛生審議会は22日に医薬品第二部会、23日に医薬品第一部会を開き、第二部会では結腸・直腸癌治療薬の「アバスチン」の1成分、第一部会では初めてのβ2刺激薬と吸入ステロイド剤を配合した気管支喘息治療薬「アドエア」
厚生労働省は新医薬品の再審査期間を、現行の原則6年から8年に延長する方針を決めた。3月の薬事・食品衛生審議会薬事分科会で正式に決定される見通しだ。希少疾病用医薬品を除く、現在再審査期間内にある2001年4月以降に承認さ
国内でインフルエンザワクチンを製造する北里研究所、阪大微生物病研究会、デンカ生研の3者は1日、新型インフルエンザ株に対応した「沈降インフルエンザワクチン(H5N1)」について、1月31日までに製造販売承認申請を行っ
薬事・食品衛生審議会医薬品第一部会は1月31日、新たな作用機序を持つ高コレステロール血症治療薬「ゼアチ錠」など、新医薬品5成分について審議、いずれも承認して差し支えないと結論した。ゼアチ錠は薬事分科会で再度審議、その他
薬事・食品衛生審議会の医薬品第二部会が25日に行われ、グラクソ・スミスクラインが申請し、製造販売する「バルトレックス顆粒50%」の承認事項一部変更承認申請について、承認して差し支えないとの結論に至った。薬事分科会に報告
厚生労働省は新医薬品の再審査期間を、現行の原則6年から8年に延長することを決め、24日に薬事・食品衛生審議会に諮問した。対象となるのは希少疾病用医薬品を除く、現在再審査期間内にある2001年4月以降に承認された新有効成
ジェンザイム・ジャパンは5日、生まれつきムコ多糖分解酵素を持たないムコ多糖症I型の治療剤として「アウドラザイム」(一般名:ラロニダーゼ 遺伝子組み換え)を発売した。蓄積したムコ多糖を分解し、症状を改善するとされる。 ム
薬事・食品衛生審議会医薬品第一部会は11月30日、難治性尋常性乾癬治療薬「ボンアルファハイ軟膏20μg/g」(一般名:タカルシトール、帝人ファーマが製造)の縛りを外し、尋常性乾癬全般を適用とする一変申請を報告・了承した
薬事・食品衛生衛生審議会の医薬品第二部会が11月29日、医薬品第一部会が同30日に開かれ、第一部会では8成分、第二部会では3成分1併用療法の新医薬品を審議、いずれも承認して差し支えないとの結論した。このうち、パーキンソ
※ 1ページ目が最新の一覧