京都大学大学院薬学研究科教授 金子 周司

薬学を志す若者は、きっと必ず自分の手で新しい薬を作り出したいと思っている。私は昔も今もそうだ。私が教授に就任した2004年は、ポストミレニアムでゲノム創薬が最も盛んだ
った時代。私も例に倣って新しい生体分子の機能を解明することで、新たな創薬標的を見出そうと努力した。
先代から引き継いだラボは、痛みの研究を長年行ってきた研究室だったので、私は痛覚を慢性化する感作現象や末梢にある痛覚センサーに直接作用する鎮痛薬が未だに存在しないことに着目し、細胞に発現する様々な環境センサーであるtransient receptor potential(TRP)チャネルが痛みに関与するとの仮説で研究を進めた。
最初に着目したTRPM2は単球系に発現し、過酸化水素で開口することから、炎症あるいは末梢神経損傷によって起こる疼痛に深く関与することを見出した。一方、冷覚センサーTRPA1は、分子状酸素の変動あるいは活性酸素によって開口し、プロリン水酸化酵素(PHD)によって修飾制御されている。
われわれは、抗癌剤オキサリプラチンによって必発する冷覚障害が、発生するシュウ酸によるPHD阻害によることを実証した。また、正座によるしびれを模した動物モデルによって、TRPA1が虚血再灌流の結果として起こる痛みの原因であることを実証した。
これらに基づいて、TRPチャネル制御による新たな鎮痛薬の開発努力が企業において現在も続いていると信じている。
しかし、私はこれらの研究を通じて、ゲノム創薬手法にかかる標的の枯渇と動物実験結果からの臨床予測性の悪さという問題に気づいた。そこで、私は全く異なる手法を用いて、疼痛に限らず様々な疾患の治療につながるドラッグリポジショニング(DR)と創薬標的の創出が同時にできるのではないかと着想し、新たな研究を開始するに至った。
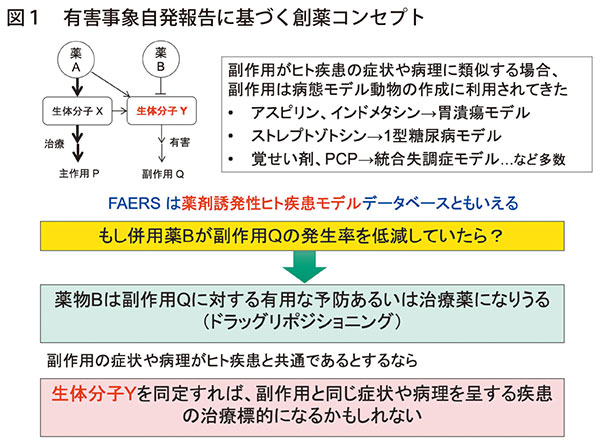
その手法とは、有害事象の自発報告、診療報酬明細書(レセプト)あるいは電子カルテなど匿名化された医療ビッグデータを用いて医薬品によって生じた有害事象を検出し、その有害事象を低減している偶然の併用薬を統計学的に見出すものであった(図1)
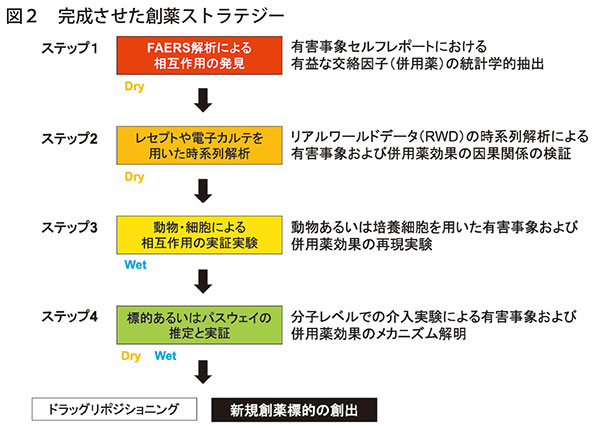
有害事象は、しばしば実験動物にて病態モデルを作出するために用いられており、実臨床で起こる有害事象を低減する併用薬は、類似する症状を起こす疾患の治療薬候補として高い臨床予測性が期待できる。実際、このようにして得られた仮説を実験動物で再現し、さらに分子細胞レベルでの機序を精査することによって、類似症状に対する治療標的を見出せる(図2)
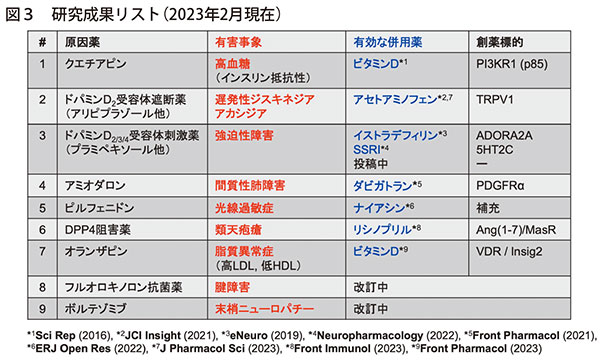
現在までに、専門である中枢神経系や疼痛に限らず、代謝免疫、筋骨格、呼吸器、皮膚などあらゆる疾患領域で見られる有害事象に対する既存薬の有効性を発見・実証してDRを提案するだけでなく、自然発症に関与する多数の治療標的分子を発見してきた(図3)
このように、ゲノム創薬と言われた分子機序からのトランスレーショナル研究にとどまらず、臨床情報の解析に基づいて得られた仮説を動物あるいは細胞を用いて実証する独創的なリバーストランスレーショナル研究を展開させたことは、いずれ訪れる医療情報化時代に花開く新たな薬学の研究領域を開拓したものと、今後の発展に期待している。