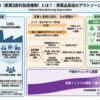
特許庁は、医薬品の新たな用法・用量を特許として認める特許・実用新案審査基準改訂案をまとめた。医薬発明を、新たな医薬用途を提供しようとする「物の発明」と定義、特定の疾病に適用する新たな投与間隔、投与手順、投与量、投与部位を発見した場合も、用途発明として保護することを明確にした。9月5日までパブリックコメントを募集し、10月をメドに新基準の運用を開始する予定。改訂後は、出願日にかかわらず、新基準に基づいて審査を行うことになる。
医薬品の新用法・用量の保護は、知的財産戦略2009が掲げる重点施策の一つ。今回、特許庁は、経済産業省の産業構造審議会審査基準専門委員会の審議を踏まえ、従来の発明と化合物や適用する疾病が同じであっても、「化合物等の属性に基づき、特定の用法または用量で特定の疾病に適用するという医薬用途において相違する場合には、新規性は否定されない」ことを、基準に追加した。
ただ、新規性が認めれても、現行基準と同じように、進歩性の要件を満たさなければならない。薬効増大、副作用低減、服薬コンプライアンスの向上のため、用法・用量を工夫することは、通常の創作能力の発揮と判断する考え方は従来通り。従来の発明と比べて有利な効果を示しても、出願時の技術水準から予測できる範囲内であれば、進歩性を否定することとしている。
また、改訂案には具体的な事例も盛り込んだ。
容認事例として、1μg/kg体重を1日1回経口投与する喘息治療薬を、30~40μg/kg体重を3カ月に1回経口投与することで、喘息症状の長期軽減と副作用低減を見出した例や、静脈投与の卵巣癌治療薬を脳内の特定部位に投与することで、優位に卵巣癌が縮小し、肝毒性を回避した事例を紹介している。
一方、拒絶事例として、160μg/kg体重を1日3回経口投与する鎮咳薬を、400μg/kg体重を1日1回経口投与に変更した例を挙げた。鎮咳効果は向上したものの、予想の範囲内にとどまり、進歩性の要件を満たせなかったことを理由として解説している。