京都薬科大学准教授 高山 健太郎

内分泌・代謝に関わる生体ペプチドを対象とした基礎研究は、生体機能の理解やペプチド関連医薬品の開発へ貢献するなど薬学発展の一翼を担ってきた。多くの生活習慣病患者を抱えつつ超高齢化社会を迎えるわが国において、今後も継続的な進展が望まれる領域である。このような背景へのアプローチとして、二つの生体分子「マイオスタチン」「ニューロメジンU(NMU)受容体」の機能制御に取り組んできた。
マイオスタチンは骨格筋量を負に制御する局所性因子であり、筋萎縮克服のための標的として有望視されている。抗体などの高分子阻害剤研究が多くなされているが、ペプチドを含む中分子以下のサイズでの阻害分子創製は未開拓であった。
私たちは、生来のマイオスタチン不活性化機構に関わる前駆体プロドメインに着目し、そのN末端領域から最小構造として23残基ペプチドの同定に成功した。本ペプチドを基盤に、マイオスタチン結合様式の解明につながる知見の獲得、阻害能の向上、困難と思われたさらなる小型化(16残基)を達成し、生体応用が期待できる酵素分解耐性を示すペプチドの創製に至っている。
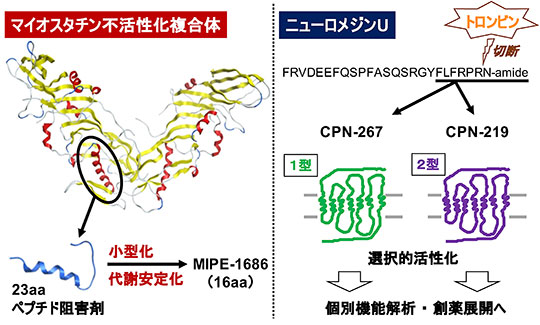
NMUは内因性の抗肥満因子として注目され、1型と2型の2種類の受容体に作用する神経ペプチドである。抗肥満の他にもストレス応答や概日リズム調節など多彩な生理作用が知られており、受容体個々の機能解明に資する選択的アゴニストの開発が求められていた。
私たちは、NMUの活性コアとされるC末端7残基をもとに誘導体展開し、世界に先駆けてヘキサペプチド型の選択的フルアゴニスト創出に成功した。
また、トロンビンがNMUの血中での鍵代謝酵素となることを、誘導体ペプチドを用いた検討で見出し、この迅速分解の回避にP4部位の誘導が有用であることを実証した。
生体で安定なペプチド分子の設計における新たな方法論の提案と合わせ、本成果が各生体分子の詳細な機能解明の端緒となることを期待している。

















