東京薬科大学講師 山田 雄二

生体内の細胞は、その多くが細胞同士や細胞外マトリックスに接着した状態で存在している。この細胞接着という現象は細胞接着受容体を介して引き起こされており、物理的に接しているだけでなく、シグナルにより増殖や分化などの様々な細胞活動をコントロールしている。われわれは細胞外マトリックスを構成する蛋白質であるラミニンから、数多くの細胞接着ペプチドを同定してきた。
これらのペプチドは、インテグリンやシンデカンといった細胞接着受容体に特異的に作用し様々な生物活性を示すため、細胞外マトリックス蛋白質の代わりとなる合成の機能性分子として医薬応用が期待される。
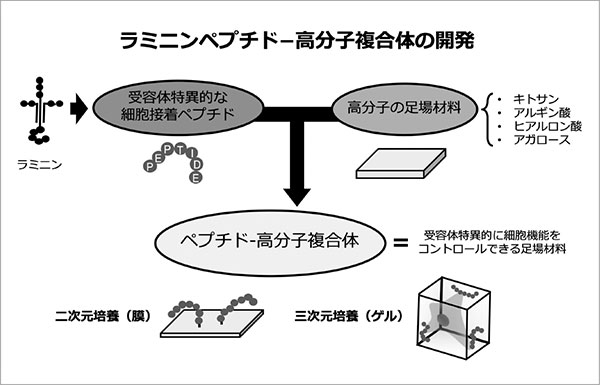
本研究では、細胞接着ペプチドを再生医療を指向した多機能性バイオマテリアルへと応用することを目的としている。具体的には、キトサン、アルギン酸、ヒアルロン酸、アガロースなどの高分子材料に種々の細胞接着ペプチドを共有結合したペプチド-高分子複合体を作製し、二次元および三次元的な細胞の足場としてその有用性を実証してきた。
さらに、これらのペプチド-高分子複合体の生物活性は、ペプチドの作用する受容体だけでなく、高分子材料の持つ電荷や硬さなどの物性より大きく異なることを明らかにしてきた。
近年では、より優れた機能を持つ細胞接着ペプチドを見出すため、ラミニンペプチドに限定することなく新規の細胞接着ペプチドの同定・最適化も行っている。例えば、細胞透過ペプチドとして知られるオクタアルギニンが細胞接着ペプチドとしても有用であることを見出し、その構造活性相関研究から、より細胞毒性が低く細胞培養に適したペプチドYR8を同定している。
また、細胞接着配列として広く知られるRGDペプチドに関する構造活性相関研究では、インテグリンαvβ5に強く結合するペプチドとしてRGDTFIを同定している。
これらの新規ペプチドは、高分子材料と組み合わせる細胞接着ペプチドの選択肢を広げ、目的に合わせたテーラーメイド型の多機能性バイオマテリアルの開発に有用であると期待される。