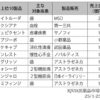
医薬品医療機器総合機構(PMDA)は15日、2016年度に審査した医薬品の承認実績を公表した。新医薬品の審査期間については、希少疾病用医薬品などの優先審査品目、通常審査品目共に14年度からスタートした第3期中期計画の目標を3年連続で達成。また、後発品の審査期間についても、新規申請と一部変更申請共に目標をクリアし、新医療機器や対外診断用医薬品なども含め、13項目全てにおいて目標審査期間を達成した。
新医薬品の審査期間については、優先審査品目が70%タイル値で8.8カ月と、目標の9カ月を下回った。通常審査品目では70%タイル値で11.6カ月と目標とする12カ月を下回った。ただ、両品目で15年度の審査期間を上回った。承認件数は、優先審査品目が38件、通常品目で74件だった。
* 全文閲覧には 薬事日報 電子版 » への申込みが必要です。