北海道大学大学院薬学研究院助教 佐藤 悠介

近年は核酸医薬や遺伝子治療、ゲノム編集治療などの治療戦略の多様化が進み、実用化も非常に加速している。これらの多くは細胞質や核などの細胞内で機能を発現する一方で、標的細胞への移行能は乏しく、生体内での安定性にも課題がある。従って、それらを効率的に標的細胞へ送達することが可能な技術が必須となる。
脂質ナノ粒子は盛んに開発が進められている送達技術の一つであり、世界初のsiRNA医薬として承認されたオンパットロや昨今のCOVID-19ワクチンの開発に大きく貢献している。脂質ナノ粒子は血中に投与されたのちに主に肝臓へ移行し、エンドサイトーシスにより取り込まれた後、膜融合を介してエンドソームから脱出することで内包した核酸を細胞質へ放出する。このエンドソームからの脱出が核酸を導入する上で強力なバリアとなる。
私たちは、エンドソーム内の酸性化に反応して正に帯電し、効率的に膜融合を惹起するpH感受性カチオン性脂質の分子デザインを基盤とした核酸送達用脂質ナノ粒子製剤の開発を進めてきた。
近年、独自のpH感受性カチオン性脂質ライブラリを構築し、構造活性相関の体系的な検討を行った。また同時に、肝臓へのsiRNA送達効率に優れるCL4H6を見出し、前述のオンパットロに含まれるpH感受性カチオン性脂質MC3と比較して遺伝子ノックダウン効率および安全性に優れることを見出した。
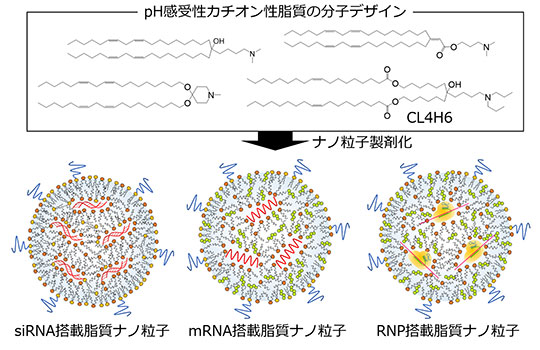
本技術をもとに、mRNAやゲノム編集ツールであるCRISPR/Cas9蛋白質-ガイドRNA複合体(RNP)送達への応用も進めている。また、脂質ナノ粒子の治療薬としての応用には高い安全性も求められることから、私たちは毒性発現メカニズムに基づく改良、脂質への生分解性の付与等、複数の異なるアプローチからの安全性の改善戦略について報告している。
私たちの試みが、今後のナノ医薬の実現へ貢献することを切に願いながら、研究に邁進していきたい。















