安全性情報管理を自動化‐業務品質確保し負担も軽減
シミックは、製薬企業の安全性情報管理部門における報告受付から当局への報告までの業務の一部を自動化するツールを来年1月にもリリースする。インドのITシステムコンサルティング企業ウルトラジェニックが開発した「UltraIntake(ウルトラインテイク)」を導入し、日本仕様に共同開発したもので、今秋にも詳細を発表する予定だ。安全性情報は多様な情報ソースから、多様なフォーマットで報告され、手作業が介在する余地が多い。その業務は年々増えており、製薬企業の課題となっている。関連業務の自動化で工数とコストの削減と共に業務品質の確保も図り、課題に応える。
増える業務に対しIT、RPA(ロボット)ソリューションが注目されているが、業務そのものの変革(DX)、効率化、コストダウンも迫られている。それら課題に応えようと開発されたのがこのツールだ。
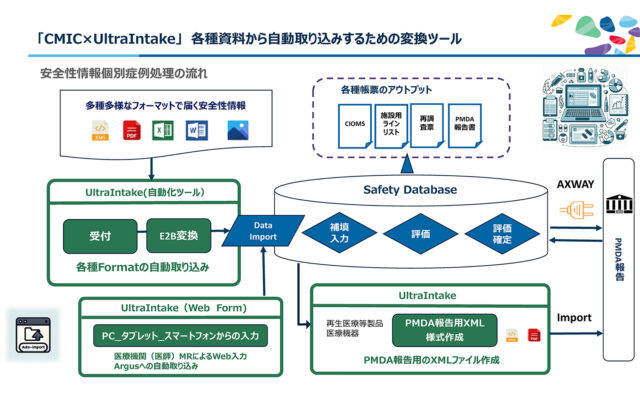
安全性情報業務の大きな課題として、情報ソースから寄せられる膨大な情報の安全性データベースへの取り込みが挙げられる。
MR、コールセンター、ソーシャルメディアなど多様な情報ソースがあり、それぞれ異なるシステムで動いている。それら情報ソースからPDF、XML、Excel、テキストなど様々なフォーマットで報告される。それゆえ、それら情報のデータベース入力の大部分が手作業となる。
この自動化ツールでは、様々なソース、フォーマットの情報を変換してデータベースへ自動で取り込む。この自動化により、工数削減、手作業の負担軽減、規制要件の遵守の実現を図る。
具体的には▽国内外の有害事象情報の共有を図る国際標準書式CIOMS(国際医学団体協議会)フォームのPDF自動取り込み▽医師、MRによるウェブ入力による受付▽当局報告用のXMLファイル作成――など。同社が、レンタルしている米オラクルの安全性データベース「Oracle Argus Safety」と連携すれば、データ管理、ラインリストの作成、海外当局報告用のCIOMS、XMLファイル作成も可能だ。
また、シミック仕様では日本独自の規制に対応する。再生医療等製品、医療機器の治験における報告では、PMDAが提供するツールへの入力が必要だが、それも自動化する機能も搭載する。
この自動化ツールはニーズに応じてカスタマイズでき、企業の業務規模、必要に応じて柔軟に利用可能。「Oracle Argus Safety」と連携したフルパッケージの提供も可能だ。
この柔軟なサービス体系を生かし、主に国内の医薬品・医療機器メーカーに最適な形を提案していく。特に安全性情報管理業務に十分なリソースを割けない国内外バイオベンチャーに訴求する方針だ。
ファーマコヴィジランス事業本部PVビジネスデベロップメントマネジャーの木許奈々子氏は、「シミックは20年近いCRO事業の経験がある。その知見を生かしてこの新しいツールの最適な組み合わせが提案できる」と強調する。
同事業本部長の廣瀬有紀子常務執行役員は、「私たちの経験を集約して最適な方法を提案する。まずは、この自動化ツールでどの程度、負担が軽減できるのか体験していただきたい」とメッセージを送る。
シミック
https://www.cmicgroup.com/solution/pv