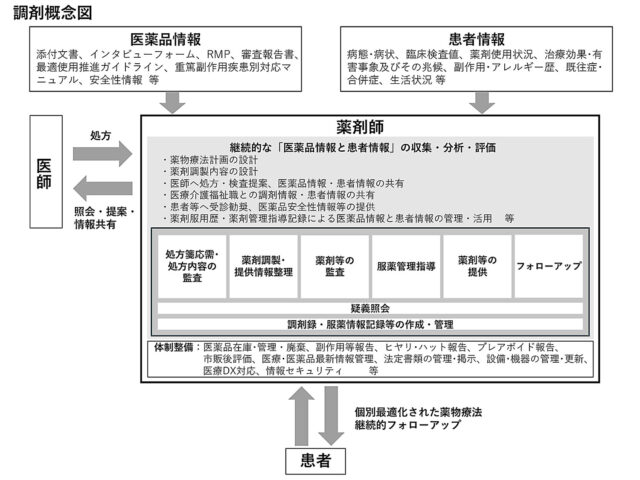
日本薬学会は、近年の薬剤師に求められる調剤業務を可視化し、薬剤師の行動目標を示すと共に、社会に対して説明責任を果たせるようにするため、「調剤の概念」を新たに策定した。薬剤師の調剤業務については、医薬品情報・患者情報を用い、薬学的観点から「処方の意図を評価し、処方を通じて患者に対して個別最適化された薬物療法を提供する」と明記。薬剤師がプロフェッショナルとしての意識を持ち、地域医療で多職種連携を通じて社会的責任を果たせるようにする狙いがある。「処方内容の監査」「薬剤調製」「薬剤等の監査」が示す業務も定義し、今後改訂される調剤指針に反映する予定だ。
HEADLINE NEWS
‐AD‐
ヘルスデーニュース‐FDA関連‐
医療機器・化粧品
書籍・電子メディア
新薬・新製品情報
人事・組織
企画
寄稿
研修会 セミナー 催し物
薬剤師認定制度認証機構 認証機関の生涯研修会
薬系大学・学部 催し物
薬学生向け情報
Press Release Title List
Press Release Title List:新製品
登録販売者試験・日程一覧