1.はじめに
いまやわが国において死亡原因の第1位となった疾患は「がん」ですが、この難病の治療薬である抗がん剤については、近年進歩が著しい「ナノテクノロジー」を利用したDDS製剤の開発が活発に行われています。既存の抗がん剤は通常全身投与となるため、副作用の発現が強く出て、がん化学療法の継続に大きな支障をきたす場合があります。抗がん剤をDDS製剤化できれば、より薬物量や投与回数の軽減が可能になり、その結果、薬の効用を高める一方で副作用を軽減するという理想的な薬物投与が可能となるのです。
今回は、がん化学療法で使用される抗がん剤の開発において重要な原理となっているEPR効果とナノテクノロジーの関係を中心に以下概説します。
2.ナノテクノロジーとDDS
一般に、経口剤にしろ注射剤にしろ薬剤を血流を介して運ぶ場合、ヒト毛細血管の直径は約5ミクロン(1ミクロンは1/1000ミリメートル)ですので、薬のサイズはそれより下の1ミクロンか、あるいはずっと小さい数ナノメートル(nm)(1ナノメートルは1/1000ミクロン)にすることが求められます。
実際、DDSとして利用される微粒子のサイズは、50 0150nm程度のものが現在中心を占めています。たとえば、がん、再生医療などを対象にしたDDSについては、薬物を封入するリポソームや高分子ミセルのサイズは数10 0数100nmの範囲にある微粒子製剤です。この微粒子のサイズはDDS製剤にとってはとても重要です。と言いますのは、微粒子のサイズが数nm以下と小さい場合、一般にヒト腎臓から尿中に容易に排泄されてしまうため体内に滞留させることが出来ずに薬剤としての効き目を発揮することが出来ません。一方、微粒子のサイズが大きすぎても不都合で、400nm以上になると今度は免疫機構が働き、マクロファージなどによる異物排除により体内から素早く排除されてしまうため、これもまた薬剤としての効き目を発揮することが出来ません。それゆえにDDS製剤としては上述した微粒子のサイズが必要なのです。そこで薬剤を血液を介して運ぶ場合には「ナノテクノロジー」(10億分の1メートルスケールの領域での製造技術)によって薬剤を膜で包み込み、病変部に到達させ、そこで薬剤をリリースして治療効果を高める手法が取られています。
3.がんとEPR効果
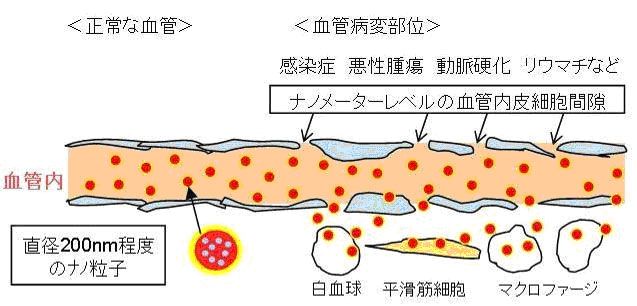
1986年に熊本大学の前田らによってEPR効果(Enhanced Permeation and Retention Effect)という重要な概念が提唱されました。すなわち、正常な血管内皮細胞とは異なり、がん組織や炎症部位の血管内皮細胞間には200nm程度の広い隙間が開口しており、100nm程度にサイズが制御された微粒子製剤や高分子製剤をがん組織に集積させることが可能なことを明らかにしています(図1参照)。
つまり、抗がん剤をナノ粒子に封入できれば、正常な血管壁からは漏れ出すことなくがん組織だけに入り、病変部位の薬剤濃度だけが上昇します(Enhanced Permeation)。更に、がん組織はリンパ管が未発達で薬物の回収機構が不完全なため結果的に薬剤が、がん組織に長時間滞留・残存することになります(Enhanced Retention)。このように抗がん剤をナノテクノロジーによりナノ粒子にすることでDDS製剤としての機能(医薬品を必要な場所に、必要な時間、必要な量だけ送達する。)が即発揮できることから、この原理を利用した抗がん剤の開発が活発に行われており、いくつかのDDS化された抗がん剤が実用化されています(表1参照)。
| 製品名 | 薬剤名 | メーカー | 適応症 | 特徴 | 発売年 |
|---|---|---|---|---|---|
| リュープリン | リュープロレリン | 武田薬品 | 前立腺癌 | PLA-PLGA製剤(sc) | 1992年(日本) |
| マイオセット | アドリアマイシン | エンゾン(米国) | 転移性乳癌 | リポソーム製剤(iv) | 2001年(欧州) |
次回(連載第7回)は、「エコ技術としてのDDS」を取り上げます。
連載 DDSの現状と展開
- 第10回 「DDSの将来像」
- 第9回 「DDSの医療以外への応用」
- 第8回 「医療現場で活躍するDDS製剤」
- 第7回 「エコ技術としてのDDS」
- 第6回 「DDSとがん治療」
- 第5回 DDSとバイオ製剤(2) ―ターゲット・徐放製剤の作製技術―
- 第4回 DDSとバイオ製剤(1) ―活性たんぱくの化学修飾技術―
- 第3回 「DDSと医薬開発システム」
- 第2回 「DDSの3大テクノロジー」
- 第1回 「DDSとは何か?」
- 「DDSの現状と展開」連載開始!