1. プログラム医療機器とは何か?その定義と特徴
プログラム医療機器は、疾病の診断・治療・予防など医療目的を果たすソフトウェアです。スマートフォンアプリやクラウド上のAIプログラムが代表例で、従来の医療機器に組み込まれたソフトとは異なり、単独で医療機器として機能します。
2014年の薬機法改正により、単体プログラムも医療機器として規制対象に含められました。『ソフトウェア単独であっても医療行為に資するなら「医療機器」』とみなされるようになったのです。
プログラム医療機器の主な特徴は汎用ハード(PC・スマホ等)上で動作し、アップデートによる機能改善が柔軟にできる点です。一方で不具合発生時は従来機器とは異なるリスク管理が必要となるため、品質管理やサイバーセキュリティ対策が極めて重要となります。
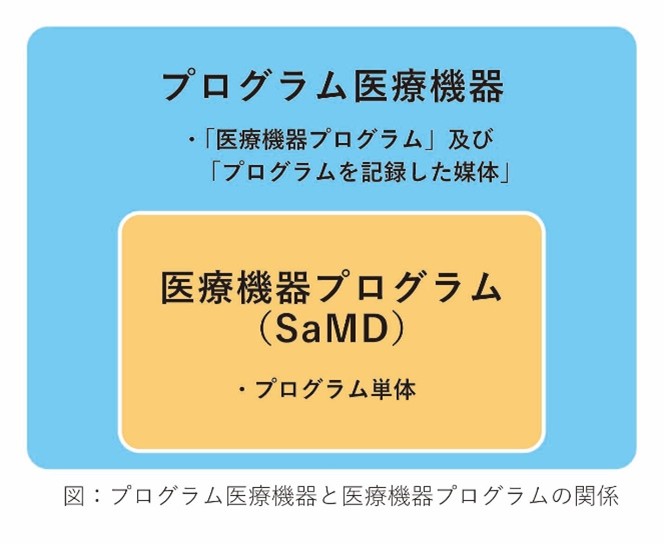
※『プログラム医療機器』と『医療機器プログラム(SaMD)』は正確には区別されているが、ここでは同じものとして扱うこととする。
| ★参考:『プログラム医療機器』と『医療機器プログラム(SaMD)』の違いとは? |
|---|
|
『プログラム医療機器』のうち、特にソフトウェア単体で流通するものが国際的にはSoftware as a Medical Device(SaMD:サムディー)と呼ばれています。日本ではSaMDを『医療機器プログラム』と呼ぶことがあります。SaMDの例としては、肺がん診断支援AI、糖尿病治療用アプリ、心電図解析ソフトなどがあります。 『プログラム医療機器』は薬機法で「医療機器のうちプログラムであるもの」と定義されています。これは、SaMD(医療機器プログラム)のようにソフトウェア単体で機能する場合と、他の医療機器に組み込まれて機能する場合、そしてプログラムを記録した媒体(CD-ROMなど)として提供される場合など、様々な形態を含むと考えられています。 つまり、『プログラム医療機器』は、医療機器プログラム(SaMD)を含む、より広い概念であると言えます。
|
2. SaMDの具体例と種類
現在実用化されているSaMDには多彩な種類があります。
診断支援系SaMD
医用画像をAIで解析して医師の診断を補助するソフトウェア。肺がんのCT画像から病変を自動検出するプログラムや、眼底写真から網膜疾患を発見するAIなどが実用化されています。
患者モニタリング系SaMD
患者のバイタルサインや症状を継続的にモニタリングすることを目的としたソフトウェア。診断、治療、またはその両方を支援するために使用され、多くの場合、遠隔医療や在宅医療の分野で活用されています。
治療用アプリ(デジタル療法・DTx(Digital Therapeutics:デジタルセラピューティクス))
デジタル技術で疾病の予防や診断、管理、治療を支援するソフトウェア。患者の行動やバイタルを記録し、適切な指導メッセージで生活習慣改善を促します。ADHDや糖尿病、禁煙などを治療するアプリなど、日本でも複数の治療用アプリが承認・保険収載されています。
このほか、手術支援系や遠隔医療系のSaMDなど、「データを解析・判断して医療にフィードバックする」すべてのソフトウェアがSaMDの範疇に含まれます。
3. 日本におけるSaMDの規制 – 薬機法での位置づけ
日本ではプログラム医療機器は法律上正式に「医療機器」として扱われます。厚生労働省の「プログラムの医療機器該当性に関するガイドライン」によれば、プログラム医療機器とは「医療機器としての目的性を有し、意図したとおりに機能しない場合に人の生命および健康に影響を与えるおそれがあるソフトウェア」とされています。
この定義に当てはまるソフトは、スマホアプリでもWebサービスでも医療機器として薬機法上の承認等が必要です。単なる歩数計アプリはリスクが非常に低いと評価され医療機器に該当しませんが、糖尿病患者のインスリン投与量を助言するようなアプリは明確にプログラム医療機器となります。
プログラム医療機器はリスクに応じてクラスI~IVに分類され、多くは患者状態に影響を及ぼすためクラスII以上に分類されます。クラス分類により求められる審査手続や管理方法が異なるため、開発者は自社製品のクラス判定を早期に見極める必要があります。
4. プログラム医療機器承認・認証の要件とプロセス
プログラム医療機器を製品化するには医療機器としての承認または認証が必要です。
承認申請にはプログラム医療機器の安全性・有効性を証明するデータ(治療用アプリなら臨床試験結果、診断ソフトなら読影精度の検証データ等)を添付する必要があります。
承認プロセスは、製造販売業許可の取得→製品ごとの承認申請→PMDA審査→厚労省による承認という流れで、ソフトウェア独自の検証(アルゴリズムの性能試験やユーザビリティ評価など)も求められます。日本では製品カテゴリごとに認証基準が策定されており、該当するSaMDは基準適合により認証手続きを簡略化できます。
PMDAは審査経験を踏まえ「審査のポイント」を公開しており、開発企業は申請前に要求水準を把握できるようになりました。近年は制度改善が進み手続きの効率化も図られています。
5. グローバルに見るSaMD規制の潮流
| 米国 | FDAがSaMDを「ハードウェア医療機器の一部でなく単独で医療目的を果たすソフトウェア」と定義し、リスクに基づきクラスI~IIIに分類しています。高リスクなものほど厳しい規制が課され、臨床決定支援ソフト(CDS)の一部を規制対象外とする線引きも行っています。 |
|---|---|
| 欧州連合(EU) | 2021年施行の医療機器規則(MDR)でSaMDに関する規定が強化されました。原則クラスIIa以上に分類するルールを設け、旧指令下でクラスIだった多くの医療ソフトがクラスII相当に引き上げられました。 |
| その他の地域 | 中国のNMPA、シンガポールHSA、カナダHealth CanadaがIMDRFガイドラインに基づく分類・審査を実施中です。各国の規制当局はSaMD特有の課題に向けたガイダンスを発行し、IMDRF文書を共通の考え方として規制調和を図る動きが活発化しています。 |
6. プログラム医療機器開発に不可欠な品質マネジメント体制
プログラム医療機器開発企業は品質マネジメントシステム(QMS)を整備し、設計から市販後監視まで一貫したプロセス管理を行う必要があります。ISO 13485に従った社内手順書を作成し、要求仕様の設定から変更管理、是正措置までの流れを明文化して運用します。
特に重要なのは設計管理と文書化です。要件定義書、設計書、テスト計画書・結果、リスク分析表などを整備し、相互の整合性(トレーサビリティ)を保ちます。JIS Q 13485への適合は事実上必須で、承認審査において「適合性調査」が行われます。
加えて、ソフトウェアライフサイクルプロセス(IEC 62304)の考慮も必要です。リスククラスに応じた開発手法や文書要件が定められており、ISO13485と併せて遵守することでソフトウェア品質を高次元で保証できます。
7. プログラム医療機器のリスクマネジメント
プログラム医療機器開発ではISO 14971に基づき、製品に関連するあらゆるハザード(危険源)を洗い出し、リスクを評価して対策を講じる必要があります。例えば診断支援AIなら「アルゴリズムが病変を見落とす」というハザードを想定し、見落としを減らす画像前処理や二重読影モード、ユーザーへの注意喚起などのリスク低減方策を実装します。
リスクマネジメントは開発初期から市販後まで継続します。設計段階でのFMEA※、テスト段階での異常シナリオ検証、市販後の不具合・ヒヤリハット事例の収集と評価を通じて、PDCAサイクルでリスクをコントロールし続けます。
特にプログラム医療機器は変更が容易な反面、変更による新たなリスク発生にも注意が必要です。アップデートのたびにリスクアセスメントをやり直し、必要な追加テストや情報提供を検討する変更管理プロセスが重要です。
※FMEAとは:Failure Mode and Effects Analysisの略で、モノづくりの設計段階でリスクを予測し、製造プロセスや製品そのものに潜むリスクを事前に取り除く管理手法。日本では「故障モード影響解析」と訳される。
8. プログラム医療機器とサイバーセキュリティ – 見えざる脅威への備え
インターネットやクラウドと連携するプログラム医療機器には、サイバーセキュリティ対策が不可欠です。医療機器へのサイバー攻撃リスクは現実的脅威として認識され、米国では2023年からサイバーセキュリティ情報の提出が医療機器申請時の必須要件となりました。
具体的対策として多層的防御が基本です。通信部分ではSSL/TLSによるデータ暗号化、利用者認証では多要素認証の導入、ソフト自体には改ざん検知機能や異常挙動検出モニタを組み込みます。収集する個人データは暗号化・匿名化して漏洩リスクを下げます。
開発者は製品リリース前の脆弱性診断実施、市販後のOSやライブラリの脆弱性情報監視、必要に応じたソフトウェアアップデート配信が求められます。”Security by Design”の実践により、開発段階からセキュリティを組み込むことが推奨されています。
9. 医療AI×SaMD:便利さの陰に潜む倫理課題
AI搭載SaMDでは説明可能性(Explainability)の確保が重要課題です。医師が結果の根拠を理解できないAIシステムでは最終判断に活かしづらく、患者も不安を感じます。画像診断AIなら病変部位のハイライト表示、予測モデルなら寄与因子の重要度表示などの工夫が求められます。
AIは学習データの性質に影響を受け、不適切なデータセットで訓練すると『バイアス(偏り)』を内在し、特定の人種・年齢・性別で性能が低下する恐れがあります。学習データの多様性確保やバイアス評価、開発段階での倫理審査委員会チェックが重要です。
AIが提示した診断・治療方針により患者に不利益が生じた場合の責任の所在も課題です。開発者はリスク説明責任を果たし、医師もAIの限界を理解した上で活用する姿勢が求められます。
10. SaMD市場の現状と拡大する将来展望
SaMD市場は世界的に高成長フェーズにあり、年平均10~20%近い成長率で拡大し、2030年頃には現在の数倍規模に達する見込みです。パンデミック以降、リモート診療や在宅ケアニーズの増大でSaMDソリューションへの期待が急速に高まりました。
日本では2017年の初承認以降、承認件数が年々増加し、2023年時点で20品目以上が承認され、4製品が公的医療保険の適用を受けています。これはプログラム医療機器が「有効性が証明された治療手段」として正式に医療システムに組み込まれ始めたことを意味します。
将来的には医薬品との連携による”デジタルコンパニオン”の登場や、診断から治療提案まで一貫して行う高度なSaMDプラットフォームの出現が予想されます。グローバル市場では競合が増え、海外製SaMDの日本参入や日本発SaMDの海外展開も活発化しています。
11. プログラム医療機器を支える技術イノベーション
プログラム医療機器の飛躍的進歩を可能にしたのは周辺技術の進化です。人工知能(AI)の発達により、画像認識やパターン解析の精度が飛躍的に向上し、人間では発見困難な微細な病変や膨大なデータ中の兆候をソフトウェアが捉えられるようになりました。
クラウドコンピューティングとIoTの普及により、病院のコンピュータでは処理しきれない大規模データ解析が可能となり、ウェアラブルデバイスが常時取得するバイタルデータをプログラム医療機器が解析してリアルタイムでアラートを出すシステムも実現しました。
その他、VR/ARを活用したリハビリ支援SaMDや手術ナビゲーションSaMD、5G通信による遠隔手術ロボットのリアルタイム制御など、最新テクノロジーを取り込んだSaMDの進化が続いています。
12. プログラム医療機器を巡る最新の制度・業界動向
日本政府は2022年「プログラム医療機器の承認審査の迅速化」を掲げ、承認実績のあるプログラム医療機器に認証基準を設定する方針を打ち出しました。PMDAは「医療機器プログラム審査室」を設置し専門審査官を配置、開発企業向け相談窓口を一元化してサポート強化を図っています。
業界団体では、日本製薬工業協会はプログラム医療機器開発のガイドや事例集を公開し、一般社団法人 保健医療福祉情報システム工業会(JAHIS)はデータ連携の在り方を検討しています。日本デジタル医学会ではDTxの臨床評価手法やエビデンス共有を進めています。
製薬企業とIT企業の協業も盛んで医薬とデジタルの融合領域として投資対象にもなっており、大手企業が専門部門を立ち上げたりスタートアップとパートナー契約を結ぶケースが増えています。
グローバルな視点では、IMDRF(International Medical Device Regulators Forum、国際医療機器規制当局フォーラム)が中心となって各国規制当局の足並みを揃える取り組みが続いています。IMDRFのSaMDリスク分類のガイドが英国やカナダで準拠採用されるなど、規制要件の共通化が進んでいるほか、アジア地域でもAHWP(アジア医療器機法規調和組織)がSaMDのガイドラインを発行し、加盟各国での導入が始まっています。米国FDAはパンデミックを経て遠隔医療やデジタルヘルスに関する規制緩和策と恒久制度化のバランスを検討中であり、欧州でも医療機器MDR下でのSaMD運用の課題(例えば臨床評価の方法論)が議論されており、欧州委員会や専門団体からガイダンス文書が出されています。
| 関連書 『医療機器プログラム(SaMD)‐その規制と市場参入の課題‐』 | |
|---|---|

|
米国Regulatory Affairs Professionals Society(RAPS)が発行した、医療機器プログラム(SaMD)に関する規制と開発実務ガイドの日本語訳版 |
| 関連書 『プログラム医療機器入門』 | |
|---|---|

|
プログラム医療機器の概要把握をはじめ、実例を参考にしたビジネスモデルの検討に役立つ一冊。 |
- 【薬事審調査会】不眠障害アプリ一変了承‐サスメドのプログラム機器(2025年08月01日)
- 【中医協】医療機器3品目等の保険適用を了承‐減酒治療補助アプリなど(2025年07月17日)
- 【テルモ/MedHub-AI】プログラム医療機器AutocathFFRの販売契約締結(2025年06月19日)
- 【SaMDサブフォーラム】保険通らなければ上場無理?‐CureApp(2025年02月17日)
- 【厚労省、経産省】SaMD産学官連携サブフォーラム(2025年02月14日)
- 【プログラム機器調査会】塩野義のビデオゲーム了承‐ADHD治療補助に使用(2025年02月10日)
- 【大塚製薬】認知症支援機器を新発売‐神経心理検査用プログラム(2025年01月21日)
- 【第57回日薬学術大会】分科会の見どころ・聞きどころ 医療機器プログラム(SaMD)を用いた新たな取り組(2024年09月17日)
- 【ExaMD】大手CROと相次ぎ契約‐新たなサービス開発へ(2024年08月29日)
- 大塚の癌ゲノム解析了承‐プログラム機器調査会(2024年08月23日)
- 【PMDA】革新薬実用化へ体制強化‐第5期中期計画で方向性(2023年10月23日)
- 【厚労省】二段階承認の考え方整理‐SaMD戦略第2弾(2023年09月12日)
- 【中医協WG】SaMD、特徴踏まえ評価を‐業界側、複数回チャレンジ申請も(2023年04月21日)
- 【プログラム機器調査会】不眠障害治療アプリ了承‐行動変容促し睡眠の質改善(2022年12月23日)
- 【SaMDフォーラム】早期承認・仮償還を要望‐上市後RWDで再評価(2022年12月07日)
- 【厚労省】プログラム機器優先審査‐5日から品目の公募開始(2022年09月09日)
- 【経産省】プログラム機器環境整備へ‐廣瀬室長、厚労省と連携強化に意欲(2022年08月03日)
- 【プログラム機器調査会】高血圧症治療アプリ承認へ‐ソフトウェア単体は国内初(2022年03月11日)
- プログラム機器指針公表へ‐関野機器審査課長「評価指標示し開発後押し」(2022年01月20日)
- 【中医協総会】保険適用の留保を決定‐プログラム機器で手続遅れ(2022年01月19日)
- 【規制改革会議】審査期間短縮を強く要望‐プログラム機器の早期承認(2021年10月29日)
- 【厚労省】実用化促進へ体制強化‐プログラム用医療機器(2021年04月02日)
- 【京大病院・黒田教授】プログラム医療機器を支援‐京大がプロジェクト発足(2021年03月23日)
- 【キュア・アップ】“治療アプリ”で治す‐NASH対象に東大が今月から臨床研究開始(2016年10月11日)